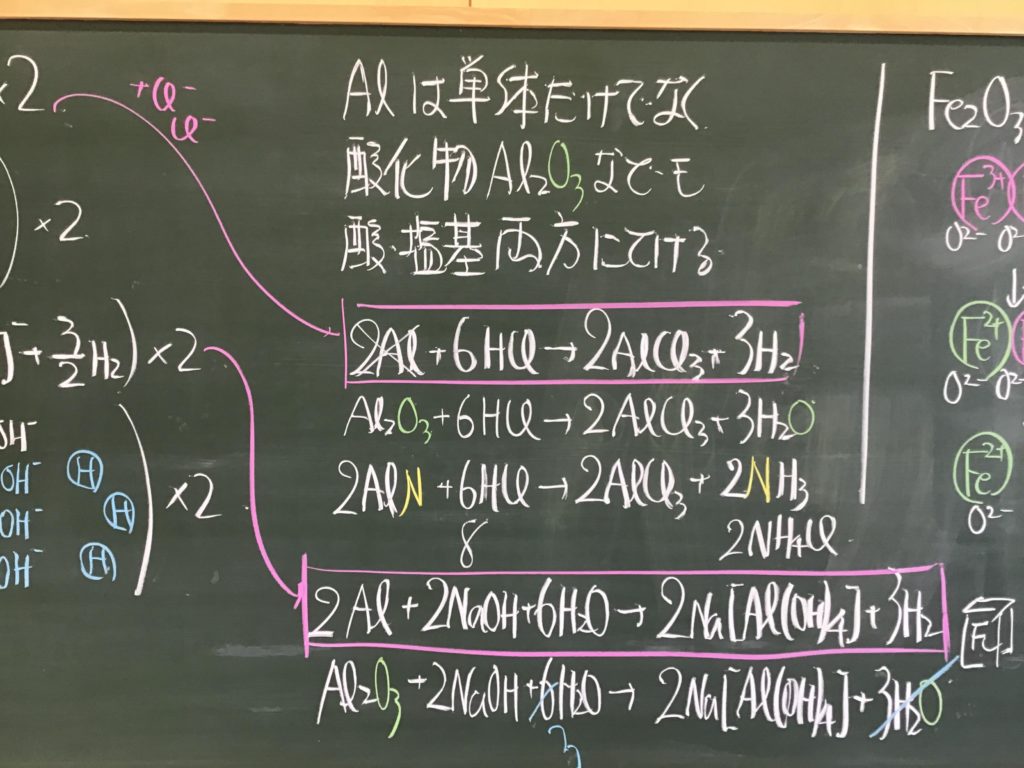
第3回目の授業板書です。
前回の「酸化還元半反応式プリント」は、北校舎5階 化学講義室前の机の上に置いてあります。出席番号偶数番号の人は、各自持って行ってください!
7/1(水)7時過ぎに僕が学校に着くまでが期限です.提出遅れの人はそこまでに出してくださいね!

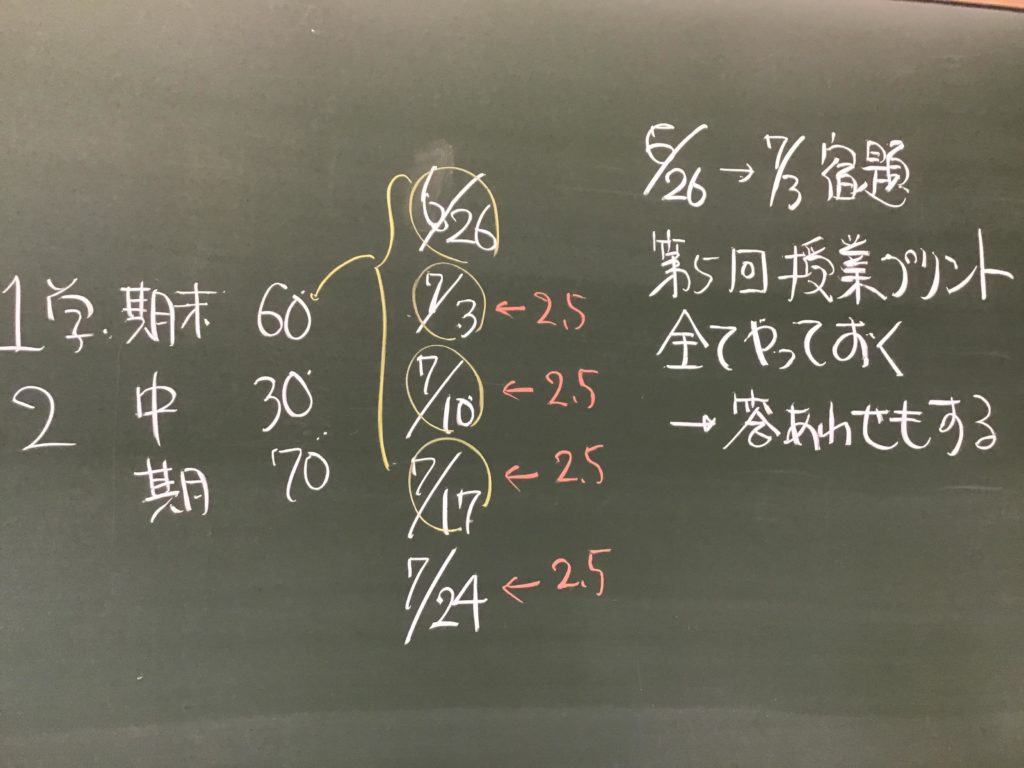


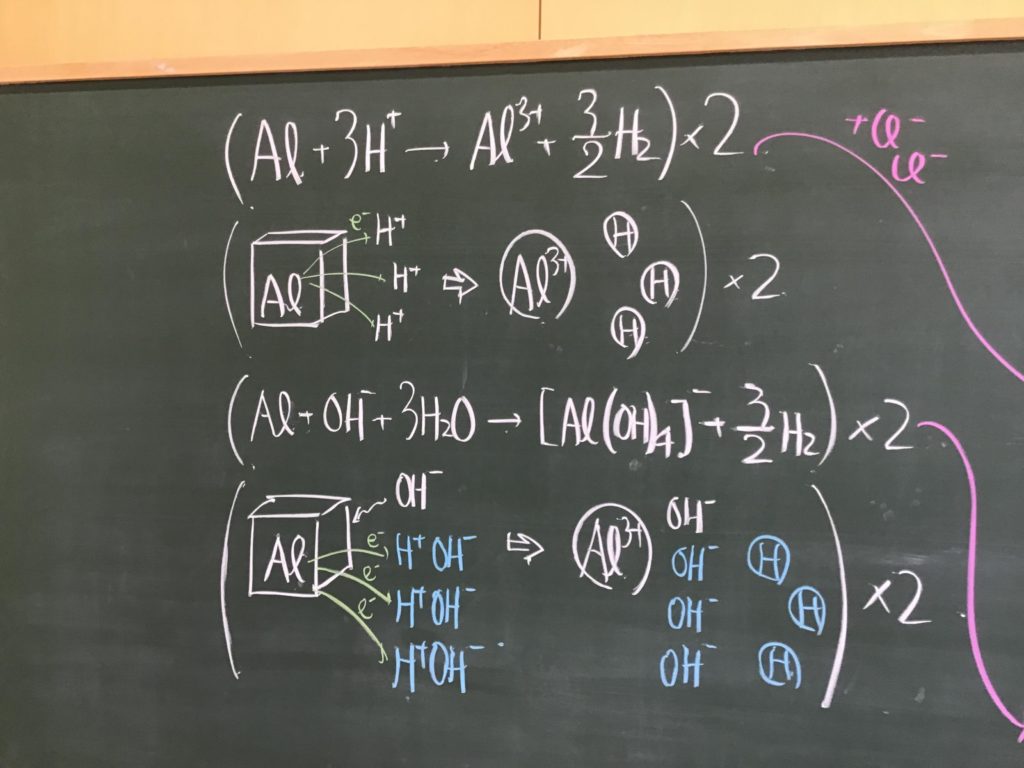
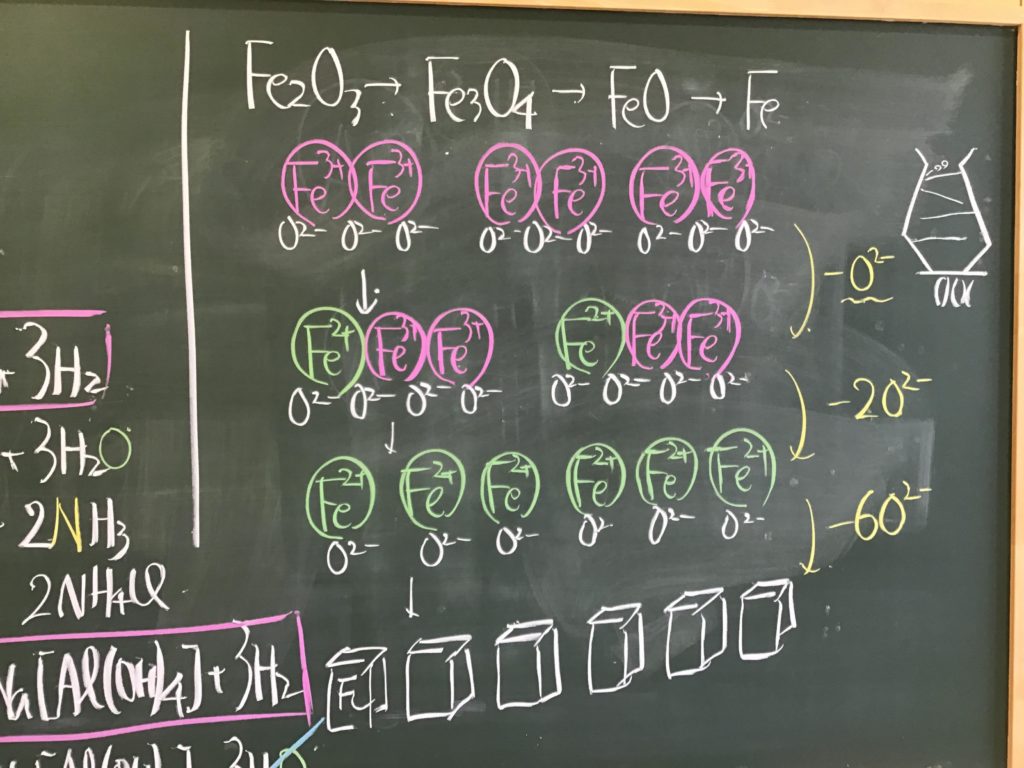
第3回目の授業板書です。
前回の「酸化還元半反応式プリント」は、北校舎5階 化学講義室前の机の上に置いてあります。出席番号偶数番号の人は、各自持って行ってください!
7/1(水)7時過ぎに僕が学校に着くまでが期限です.提出遅れの人はそこまでに出してくださいね!

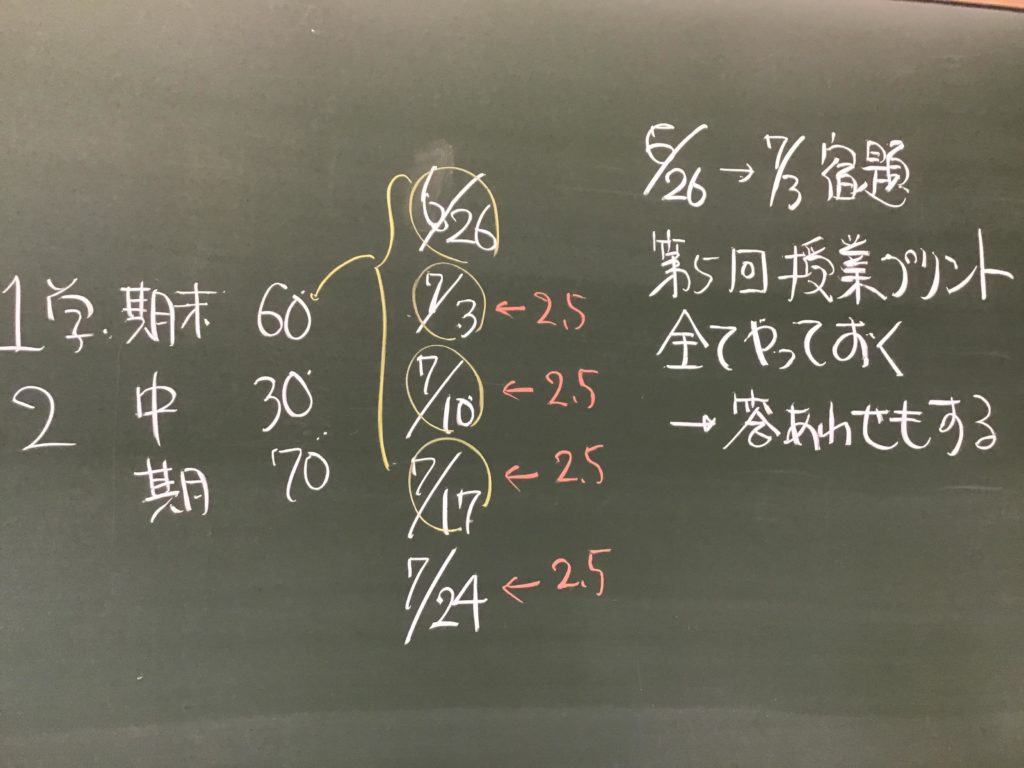


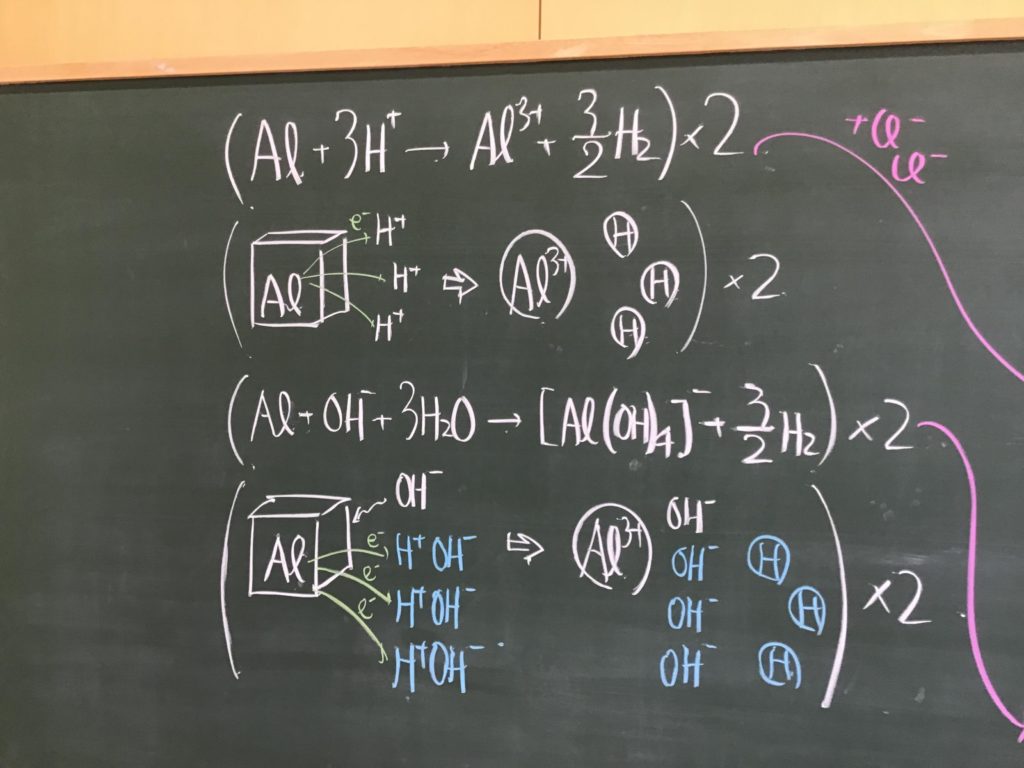

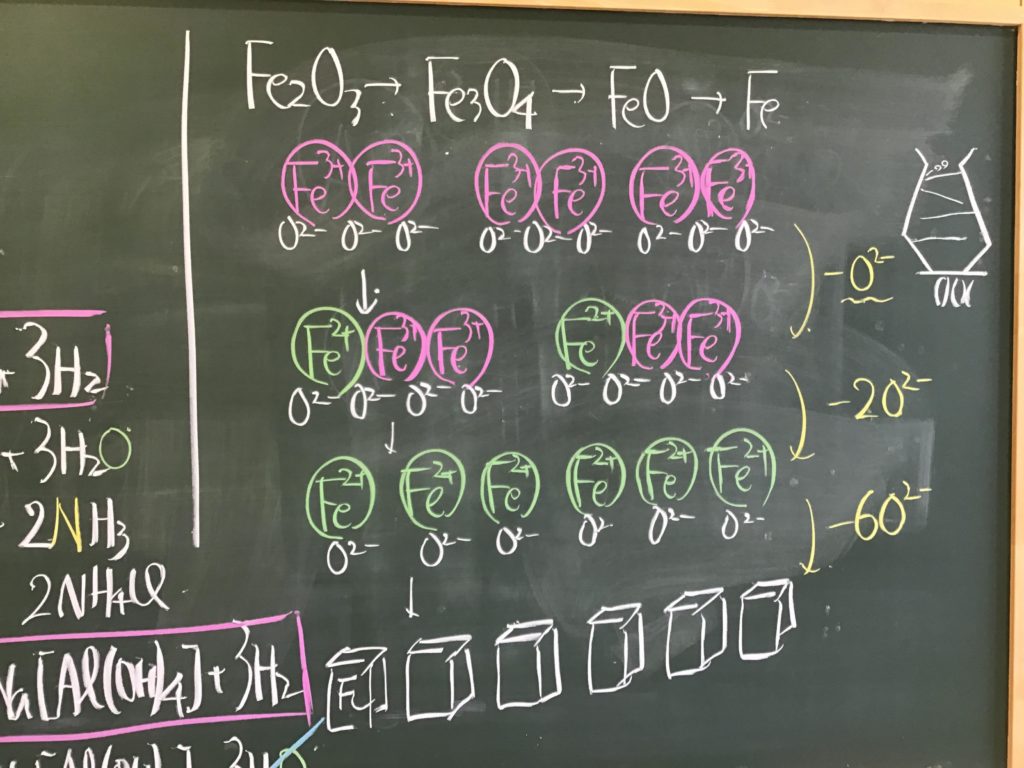
第3回目の授業板書です。




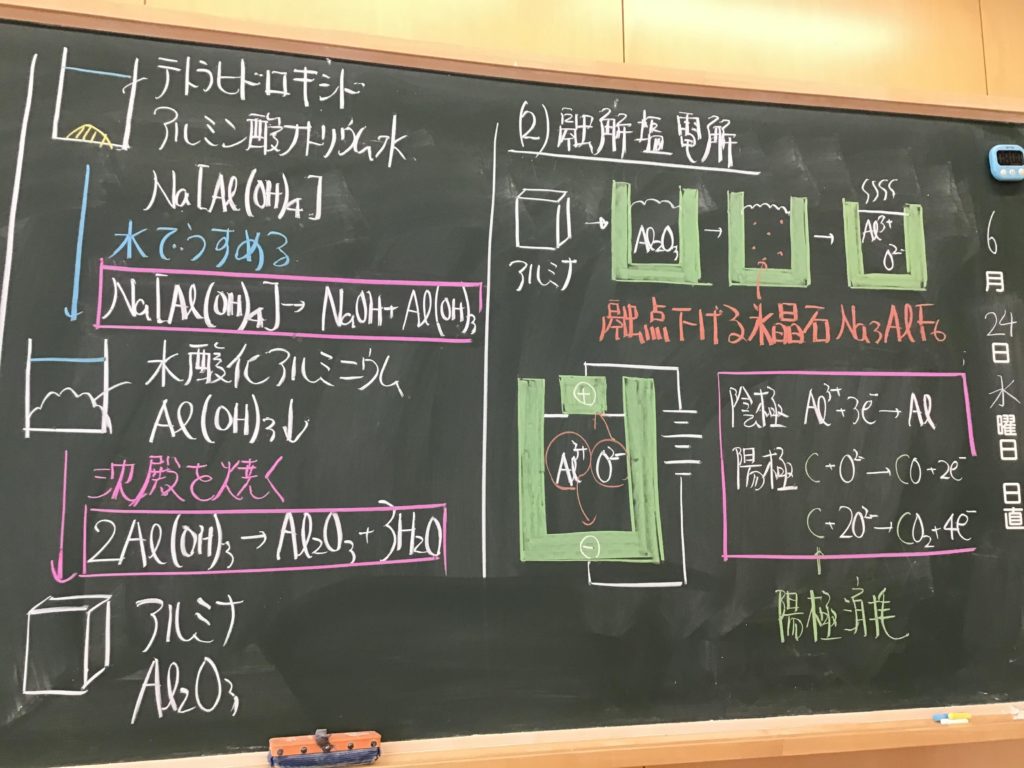

第3回目の授業板書です。




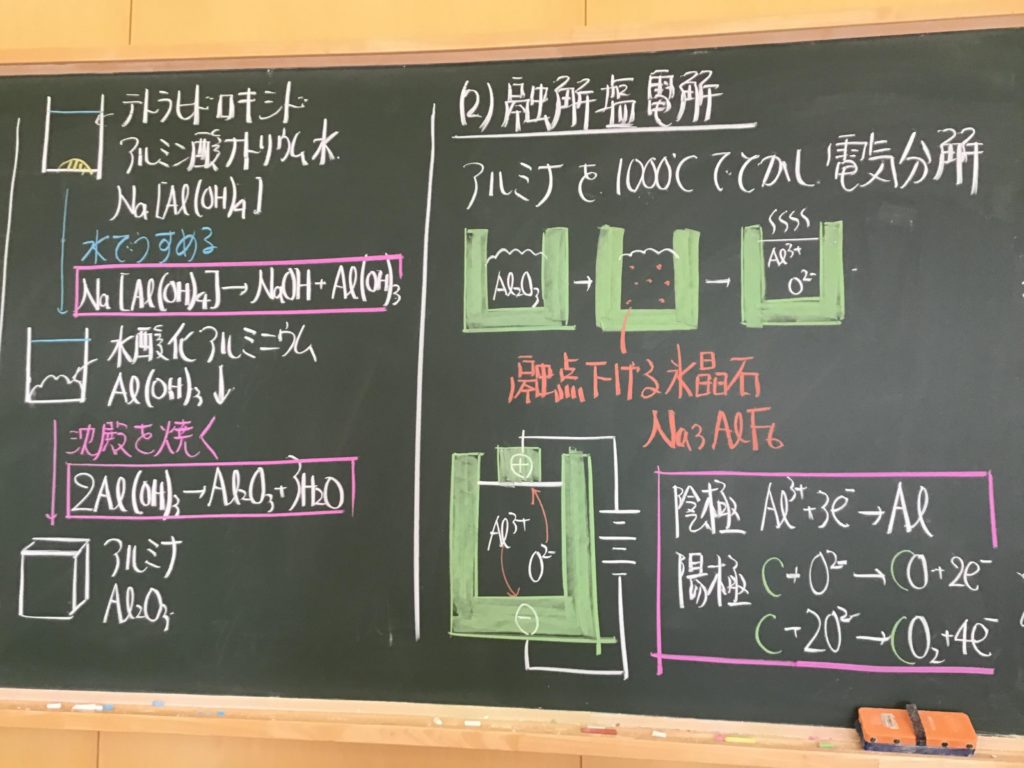

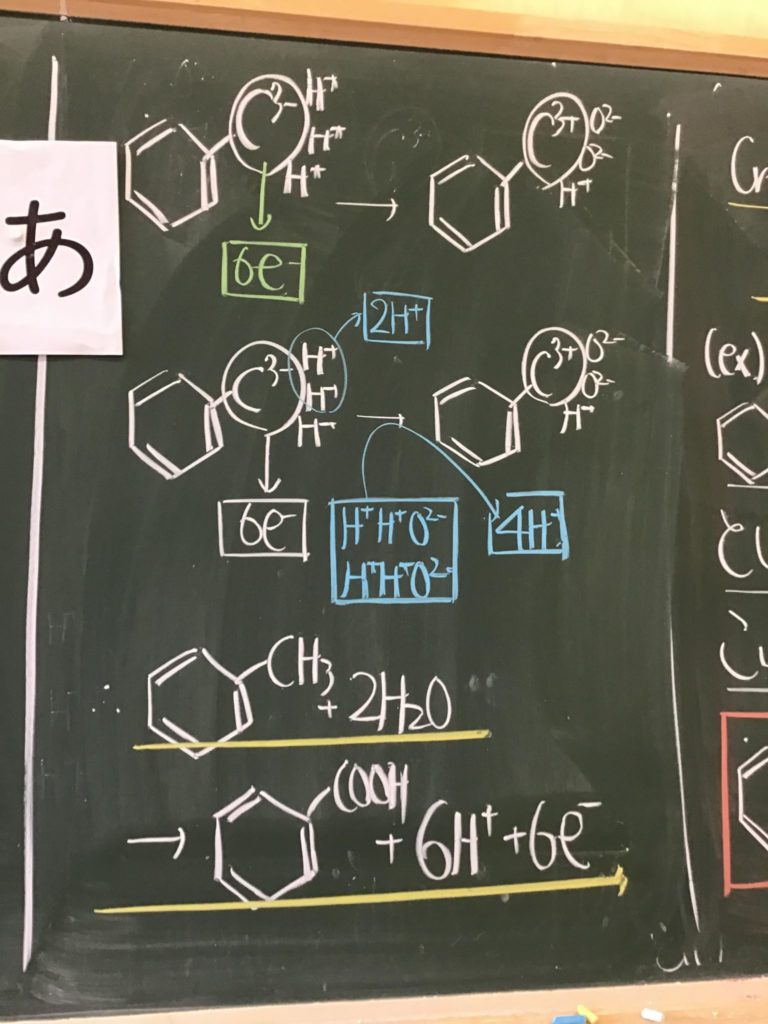
第2回目の授業板書です。
プリントそのものは、北校舎5階 化学講義室前の机の上に置いてあります。出席番号偶数番号の人は、各自持って行ってください!



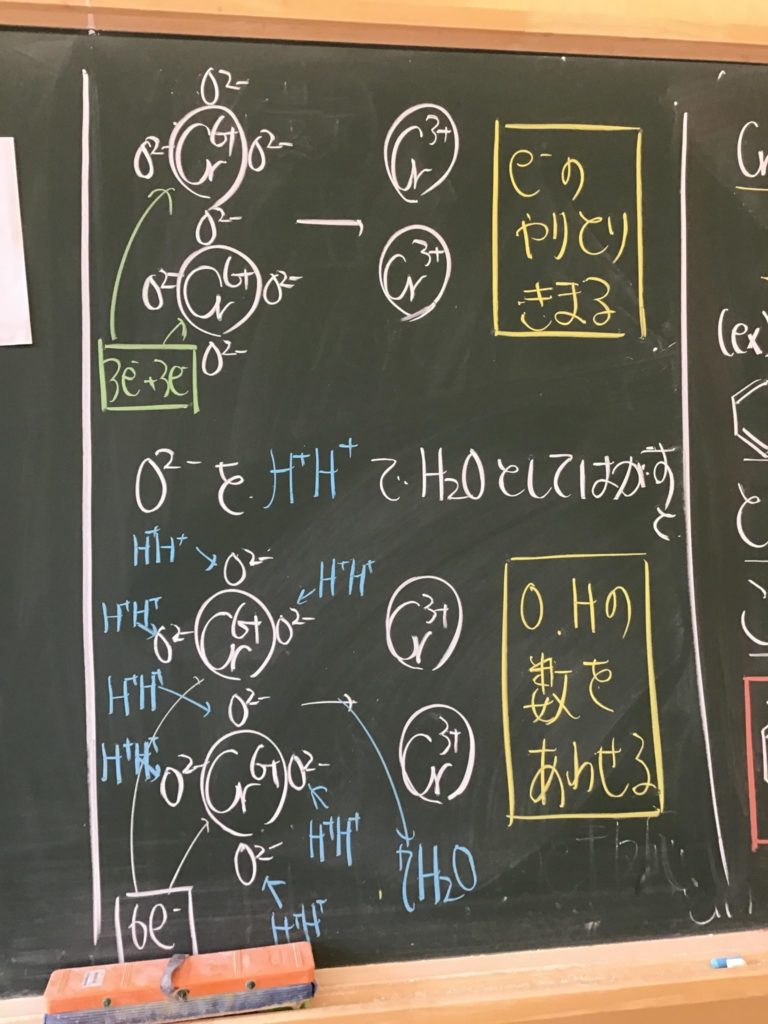
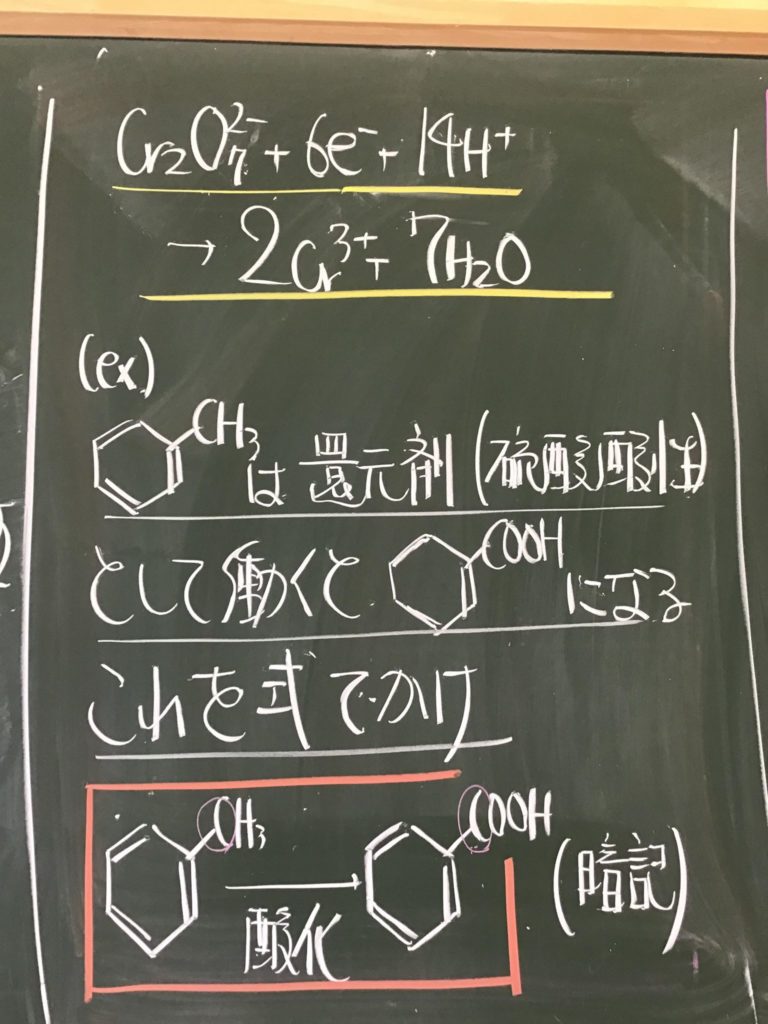
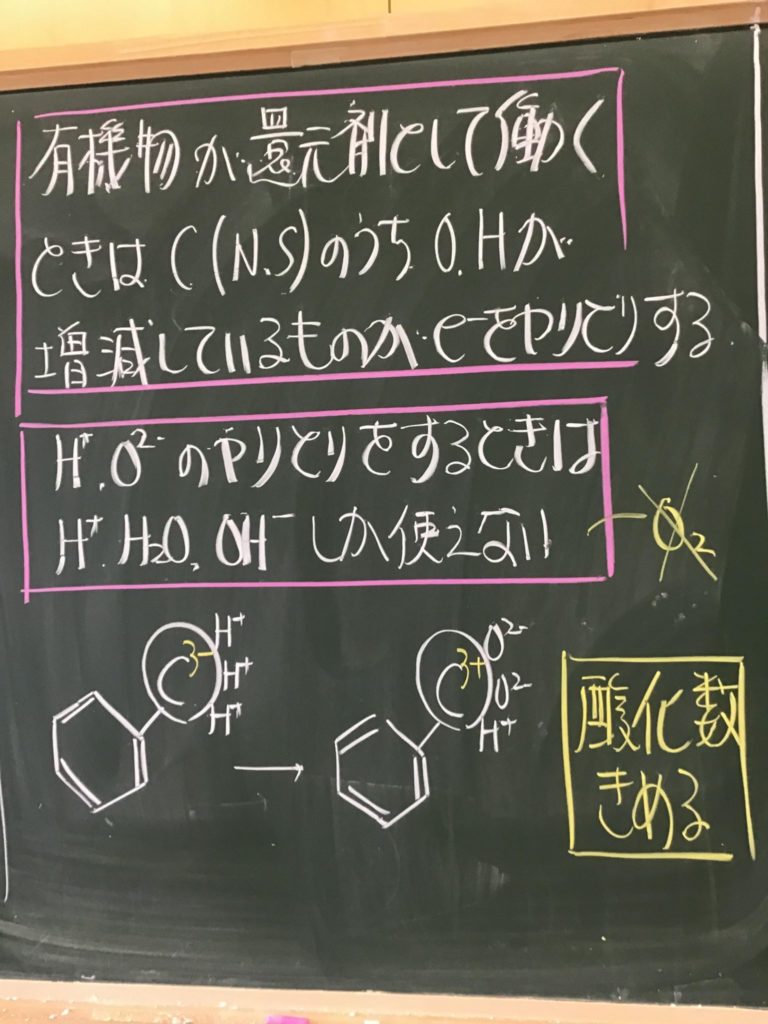
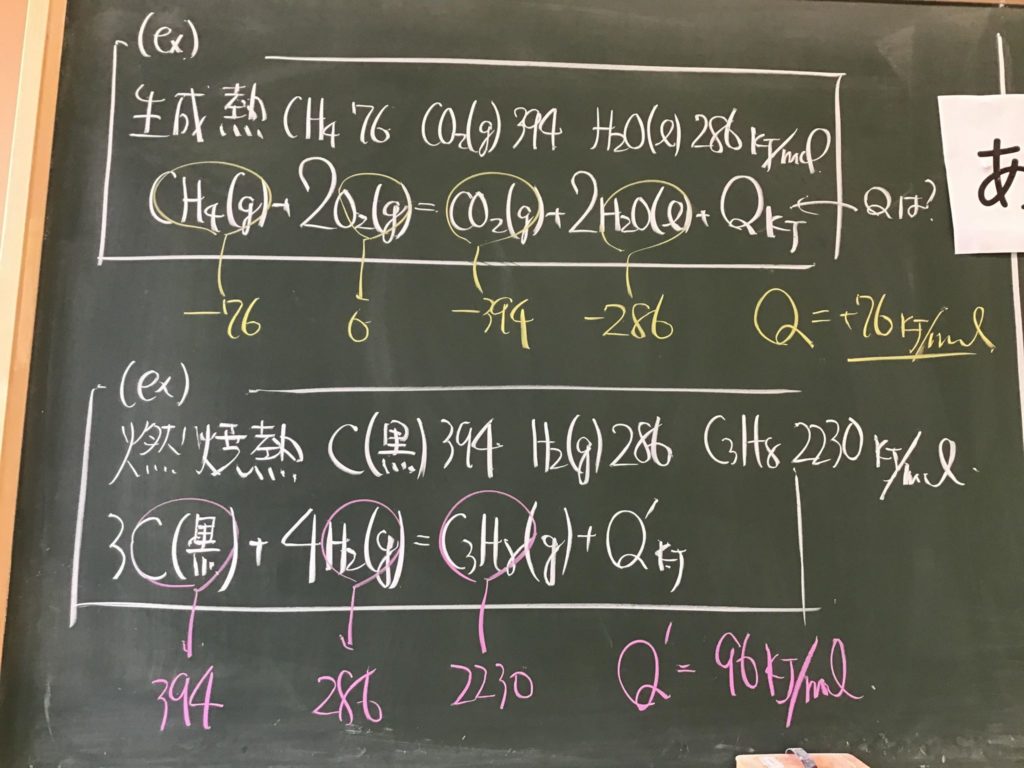
第2回目の授業板書です。
プリントそのものは、北校舎5階 化学講義室前の机の上に置いてあります。出席番号偶数番号の人は、各自持って行ってください!



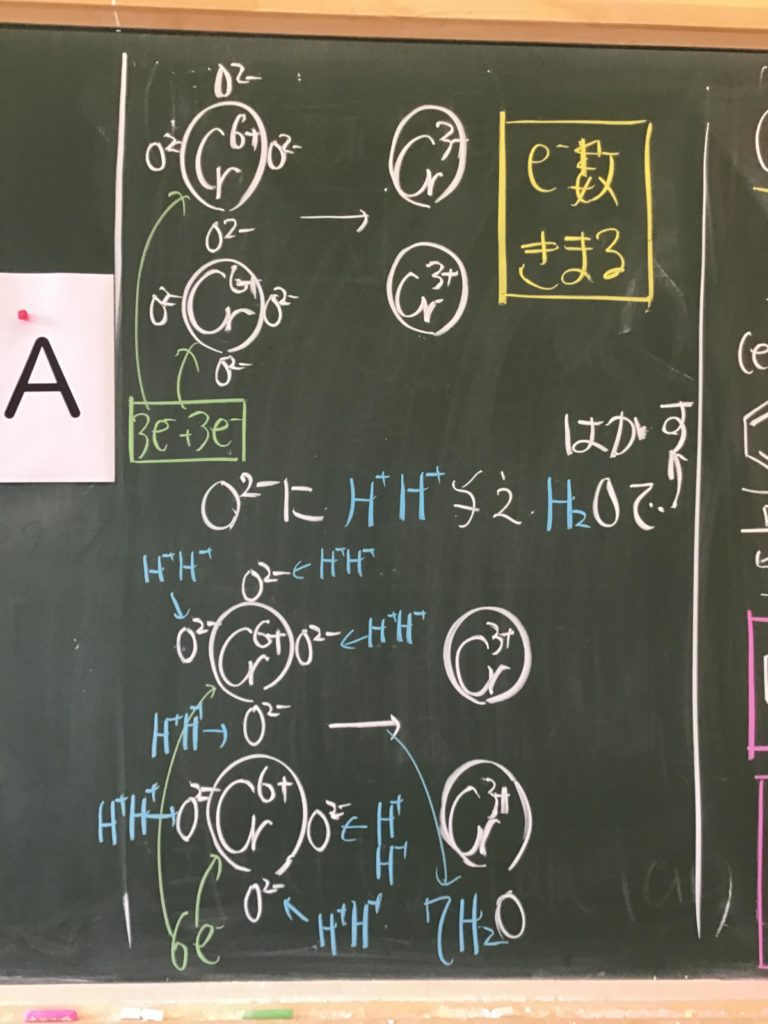
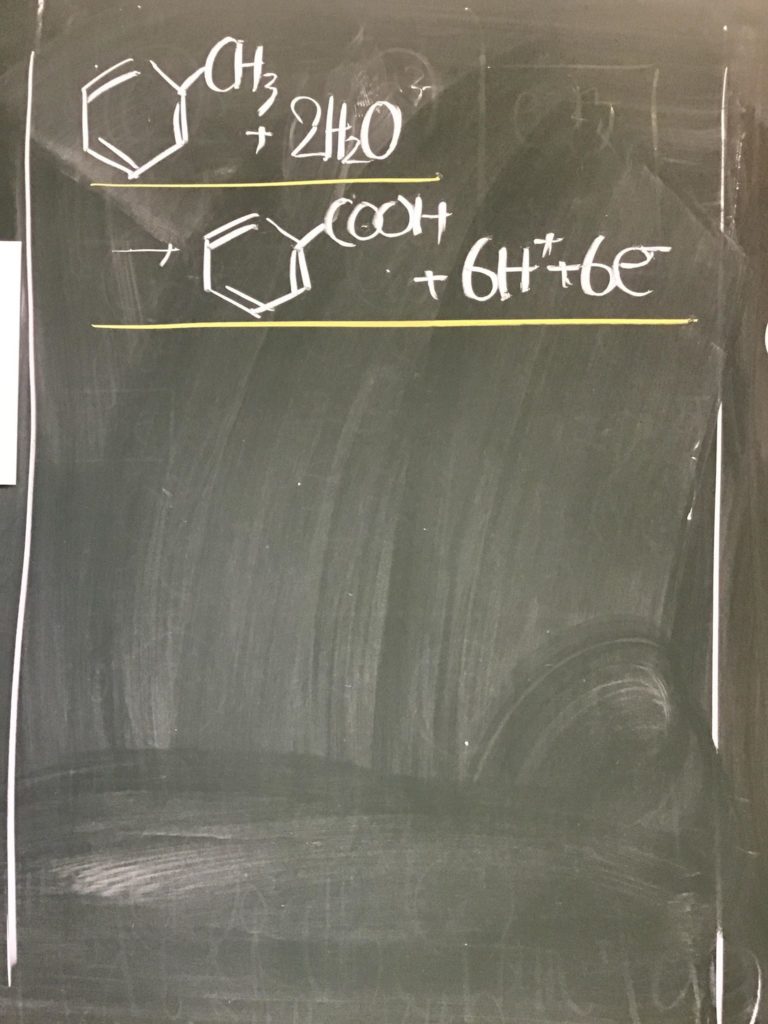

第2回目の授業板書です。
プリントそのものは、北校舎5階 化学講義室前の机の上に置いてあります。出席番号奇数番号の人は、各自持って行ってください!


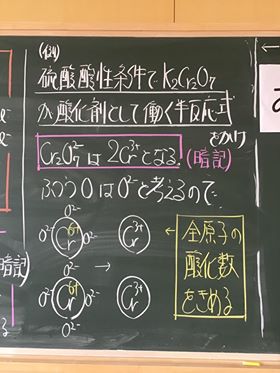
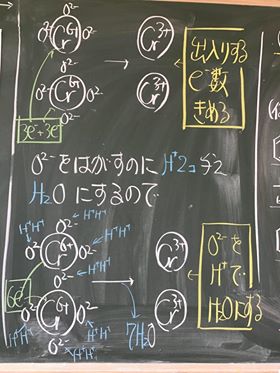
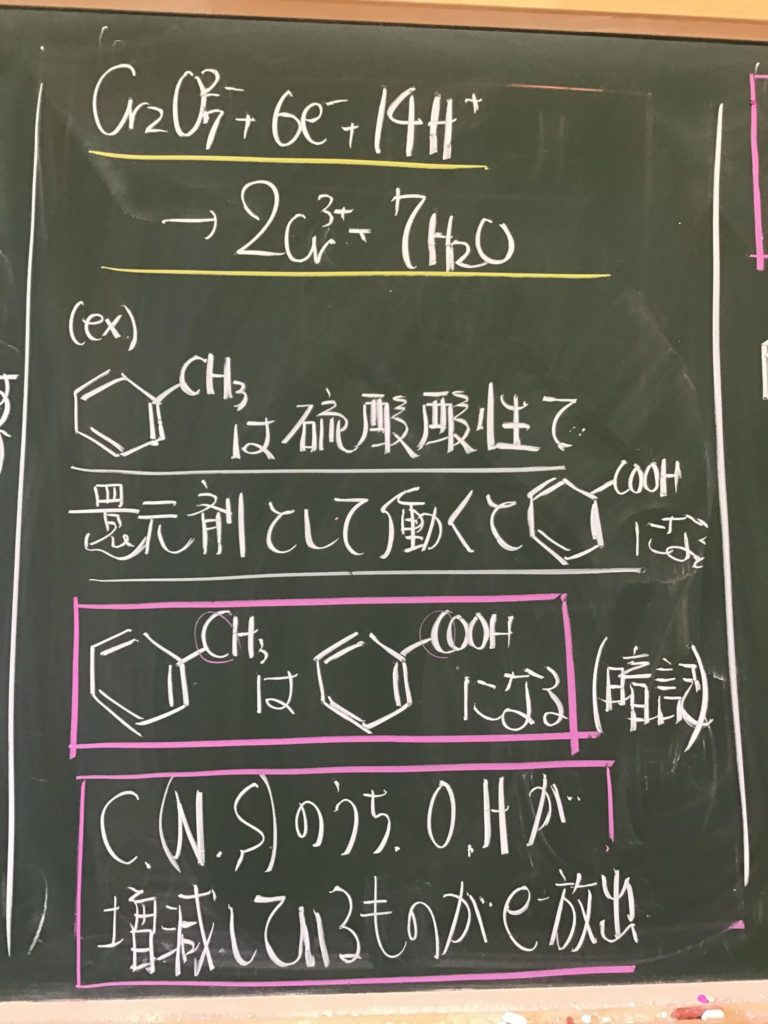
第2回目の授業板書です。
プリントそのものは、北校舎5階 化学講義室前の机の上に置いてあります。出席番号奇数番号の人は、各自持って行ってください!



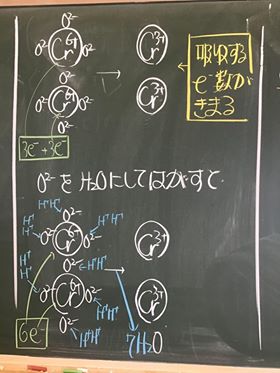


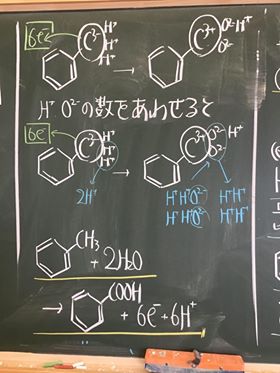
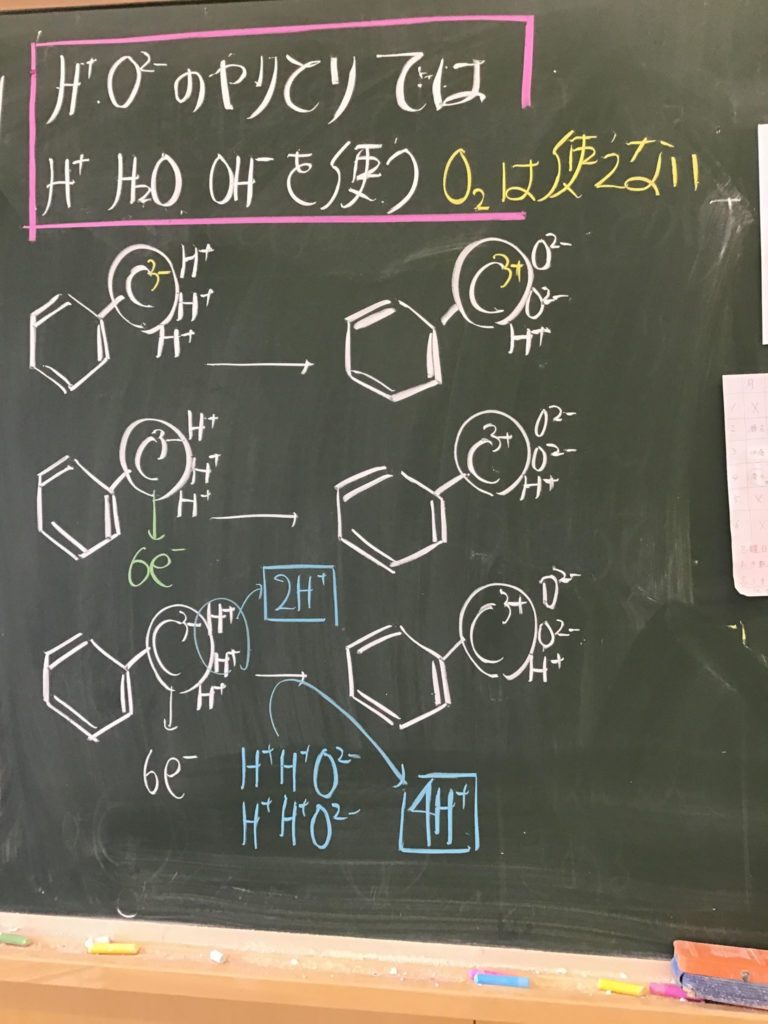
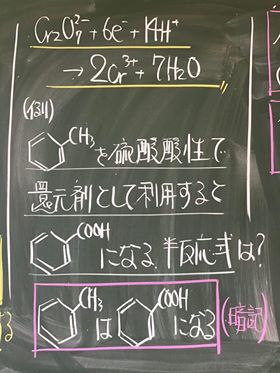
[ 1 ] 過マンガン酸カリウムが硫酸酸性条件で酸化剤として働く事例
① 過マンガン酸カリウムは化学記号で表すと KMnO4
② 過マンガン酸カリウムを水に溶かすと電離し, K+ イオンと, MnO4− イオンに。
③ マンガンを含んでいるイオンはそのうち, MnO4− イオン(赤紫色)
④ このイオンは,反応すると Mn2+ イオンに変化する。(うすい桃色〜無色)
⑤ 以上より,過マンガン酸イオン MnO4− は,硫酸酸性条件下で酸化剤として働き
マンガン(II)イオン Mn2+ に変化する。
⑥ 過マンガン酸カリウムが,硫酸酸性条件下で働くとマンガン(II)イオンになる。
MnO4− → Mn2+
⑦ このときの様子を図にすると以下の通りである。
⑧ 酸素は,単体でない限り酸化数は − 2 である。
⑨ これより,左辺のOとMnの酸化数を決定すると以下の通りである。
⑩ 上の図から,マンガンの酸化数は, +7 から +2 に減少している。
⑪ よって,吸収している電子は 5 e−である。
⑫ これを図にすると以下の通りである。
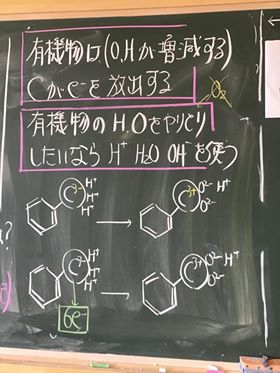
⑬ MnO4−のまわりについている酸化物イオンO2−は,硫酸で酸性にして,H+を与える
ことで,H2Oとしてはがす。そのため,一つの酸化物イオンO2−をはがすには,
水素イオンH+は, 2 個必要である。O2− + H+ + H+ → H2O
⑭ そのためこの場合,4個の酸化物イオンをはがすために,水素イオンは 8 個必要。
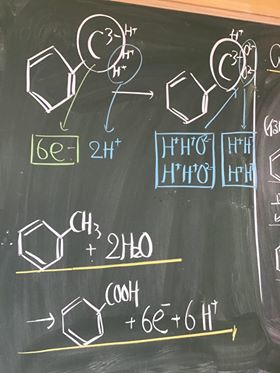
⑮ これを図にすると以下の通りとなる。
⑯ よって,この図より,MnO4−は,1個あたり, 5 e−と, 8 H+を吸収し,
Mn2+1個と, 4 H2Oを放出することが判る。
⑰ 以上をまとめると以下の半反応式となる。
MnO4− + ( 5 )e− + ( 8 )H+ → Mn2+ + ( 4 )H2O
⑱ もう一度全て自分で書くと以下の半反応式となる。
MnO4− +5e− + 8H+ → Mn2+ + 4H2O
⑲ ここで,酸化物イオンO2−をはがすための酸は,強酸であれば何でもいいように見える。
強酸は他に 塩酸(HCl水溶液)や 硝酸(HNO3水溶液)があるが,
これらは硫酸の代わりに 使えない 。
⑳ それは,塩酸(HCl)のCl−は 2Cl−→Cl2 + 2e− として電子を放出する 還元 剤,
硝酸(HNO3)のNO3−は NO3− + 4H+ + 3e− → NO + 2H2O として電子を吸収する
酸化 剤になるため,酸化物イオンをはがす以外の余計な反応をするから。
【教科書の手法との整合性の確認】
❶ 過マンガン酸カリウムKMnO4は水中で電離して K+ と MnO4− になる。(暗記)
❷ 酸化剤として働く場合,MnO4− は, Mn2+ になる。(暗記)
❸ これを式にすると以下の通り。MnO4− → Mn2+
❹ ここで左右の酸素Oの数を比較すると,左は 4 個,右は0個である。
❺ 酸素Oを取り去るには酸性条件なら普通 H+ イオンを加える。
❻ つまり,4個の酸素Oを取り去るには,水素イオンH+ が 8 個必要。
❼ 水素イオンH+を8個与えて酸素Oを4つ取り去ると,水H2Oは 4 個出来る。
❽ 以上を式に書き入れると,MnO4− + ( 8 )H+ → Mn2+ + ( 4 )H2O
❾ 次に左右の±の合計を比較してみる。
左は,MnO4−が −1,8H+ が+8なので,これをたすと,−1 + (+8) = +7
右は,Mn2+が +2,H2Oが 0 なので,これをたすと, +2 + 0 = +2
❶ つまり,+7が+2に減っているため,左側から5を引けば良い。
つまり左辺に, 5 e− を足せば良い。
❷ 以上より,まとめると,MnO4− + ( 8 )H+ + ( 5 ) e− → Mn2+ + ( 4 )H2O
❸ もう一度自分で書くと以下の通り。 MnO4− +5e− + 8H+ → Mn2+ + 4H2O
[ 1 ] 過マンガン酸カリウムが硫酸酸性条件で酸化剤として働く事例
① 過マンガン酸カリウムは化学記号で表すと KMnO4
② 過マンガン酸カリウムを水に溶かすと電離し, K+ イオンと, MnO4− イオンに。
③ マンガンを含んでいるイオンはそのうち, MnO4− イオン(赤紫色)
④ このイオンは,反応すると Mn2+ イオンに変化する。(うすい桃色〜無色)
⑤ 以上より,過マンガン酸イオン MnO4− は,硫酸酸性条件下で酸化剤として働き
マンガン(II)イオン Mn2+ に変化する。
⑥ 過マンガン酸カリウムが,硫酸酸性条件下で働くとマンガン(II)イオンになる。
MnO4− → Mn2+
⑦ このときの様子を図にすると以下の通りである。
⑧ 酸素は,単体でない限り酸化数は − 2 である。
⑨ これより,左辺のOとMnの酸化数を決定すると以下の通りである。
⑩ 上の図から,マンガンの酸化数は, +7 から +2 に減少している。
⑪ よって,吸収している電子は 5 e−である。
⑫ これを図にすると以下の通りである。
⑬ MnO4−のまわりについている酸化物イオンO2−は,硫酸で酸性にして,H+を与える
ことで,H2Oとしてはがす。そのため,一つの酸化物イオンO2−をはがすには,
水素イオンH+は, 2 個必要である。O2− + H+ + H+ → H2O
⑭ そのためこの場合,4個の酸化物イオンをはがすために,水素イオンは 8 個必要。
⑮ これを図にすると以下の通りとなる。
⑯ よって,この図より,MnO4−は,1個あたり, 5 e−と, 8 H+を吸収し,
Mn2+1個と, 4 H2Oを放出することが判る。
⑰ 以上をまとめると以下の半反応式となる。
MnO4− + ( 5 )e− + ( 8 )H+ → Mn2+ + ( 4 )H2O
⑱ もう一度全て自分で書くと以下の半反応式となる。
MnO4− +5e− + 8H+ → Mn2+ + 4H2O
⑲ ここで,酸化物イオンO2−をはがすための酸は,強酸であれば何でもいいように見える。
強酸は他に 塩酸(HCl水溶液)や 硝酸(HNO3水溶液)があるが,
これらは硫酸の代わりに 使えない 。
⑳ それは,塩酸(HCl)のCl−は 2Cl−→Cl2 + 2e− として電子を放出する 還元 剤,
硝酸(HNO3)のNO3−は NO3− + 4H+ + 3e− → NO + 2H2O として電子を吸収する
酸化 剤になるため,酸化物イオンをはがす以外の余計な反応をするから。
【教科書の手法との整合性の確認】
❶ 過マンガン酸カリウムKMnO4は水中で電離して K+ と MnO4− になる。(暗記)
❷ 酸化剤として働く場合,MnO4− は, Mn2+ になる。(暗記)
❸ これを式にすると以下の通り。MnO4− → Mn2+
❹ ここで左右の酸素Oの数を比較すると,左は 4 個,右は0個である。
❺ 酸素Oを取り去るには酸性条件なら普通 H+ イオンを加える。
❻ つまり,4個の酸素Oを取り去るには,水素イオンH+ が 8 個必要。
❼ 水素イオンH+を8個与えて酸素Oを4つ取り去ると,水H2Oは 4 個出来る。
❽ 以上を式に書き入れると,MnO4− + ( 8 )H+ → Mn2+ + ( 4 )H2O
❾ 次に左右の±の合計を比較してみる。
左は,MnO4−が −1,8H+ が+8なので,これをたすと,−1 + (+8) = +7
右は,Mn2+が +2,H2Oが 0 なので,これをたすと, +2 + 0 = +2
❶ つまり,+7が+2に減っているため,左側から5を引けば良い。
つまり左辺に, 5 e− を足せば良い。
❷ 以上より,まとめると,MnO4− + ( 8 )H+ + ( 5 ) e− → Mn2+ + ( 4 )H2O
❸ もう一度自分で書くと以下の通り。 MnO4− +5e− + 8H+ → Mn2+ + 4H2O
化学基礎【酸化還元】 半反応式の習得
空欄( )または に記入をしなさい.図はみんなで一緒に記入します.
[ 1 ] 過マンガン酸カリウムが硫酸酸性条件で酸化剤として働く事例
① 過マンガン酸カリウムは化学記号で表すと
② 過マンガン酸カリウムを水に溶かすと電離し,
イオンと, イオンに変化する.
③ マンガンを含んでいるイオンはそのうち, イオン(赤紫色)
④ このイオンは,反応すると イオンに変化する.(うすい桃色〜無色)
⑤ 以上より,過マンガン酸イオン は,硫酸酸性条件下で酸化剤として働き
マンガン(II)イオン に変化する.
⑥ 過マンガン酸カリウムが,硫酸酸性条件下で働くとマンガン(II)イオンになる.
MnO4− → Mn2+
⑦ このときの様子を図にすると以下の通りである.
| |
⑧ 酸素は,単体でない限り酸化数は である.
⑨ これより,左辺のOとMnの酸化数を決定すると以下の通りである.
⑩ 上の図から,マンガンの酸化数は, から に減少している.
⑪ よって,吸収している電子は e−である.
⑫ これを図にすると以下の通りである.
⑬ MnO4−のまわりについている酸化物イオンO2−は,硫酸で酸性にして,H+を与える
ことで,H2Oとしてはがす.そのため,一つの酸化物イオンO2−をはがすには,
水素イオンH+は, 個必要である.
O2− + H+ + H+ → H2O
⑭ そのためこの場合,4個の酸化物イオンをはがすために,水素イオンは 個必要.
⑮ これを図にすると以下の通りとなる.
⑯ よって,この図より,MnO4−は,1個あたり, e−と, H+を吸収し,
Mn2+1個と, H2Oを放出することが判る.
⑰ 以上をまとめると以下の半反応式となる.
MnO4− + ( )e− + ( )H+ → Mn2+ + ( )H2O
⑱ もう一度全て自分で書くと以下の半反応式となる.
⑲ ここで,酸化物イオンO2−をはがすための酸は,強酸であれば何でもいいように見える.
強酸は他に (HCl水溶液)や (HNO3水溶液)があるが,
これらは硫酸の代わりに .
⑳ それは,塩酸(HCl)のCl−は 2Cl−→Cl2 + 2e− として電子を放出する 剤,
硝酸(HNO3)のNO3−は NO3− + 4H+ + 3e− → NO + 2H2O として電子を吸収する
剤になるため,酸化物イオンをはがす以外の余計な反応をするから.
【教科書の手法との整合性の確認】
❶ 過マンガン酸カリウムKMnO4は水中で電離して K+ と になる.(暗記)
❷ 酸化剤として働く場合,MnO4− は, になる.(暗記)
❸ これを式にすると以下の通り.
MnO4− → Mn2+
❹ ここで左右の酸素Oの数を比較すると,左は 個,右は0個である.
❺ 酸素Oを取り去るには酸素O1個あたり酸性条件なら普通 イオンを加える.
❻ つまり,4個の酸素Oを取り去るには,水素イオンH+ が 個必要.
❼ 水素イオンH+を8個与えて酸素Oを4つ取り去ると,水H2Oは 個出来る.
❽ 以上を式に書き入れると,
MnO4− + ( )H+ → Mn2+ + ( )H2O
❾ 次に左右の±の合計を比較してみる.
左は,MnO4−が −1,8H+ が+8なので,これをたすと,−1 + (+8) =
右は,Mn2+が +2,H2Oが 0 なので,これをたすと, +2 + 0 =
10 つまり,+7が+2に減っているため,左側から5を引けば良い.
つまり左辺に, e− を足せば良い.
11 以上より,まとめると,MnO4− + ( )H+ + ( ) e− → Mn2+ + ( )H2O
12 もう一度自分で書くと以下の通り.