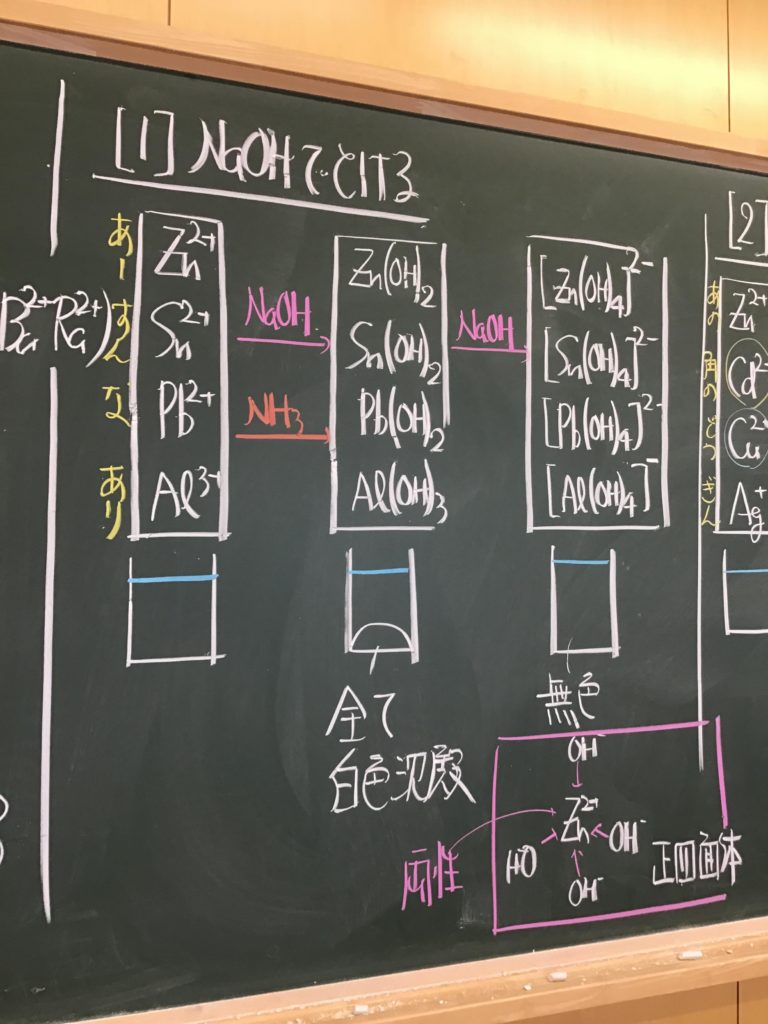
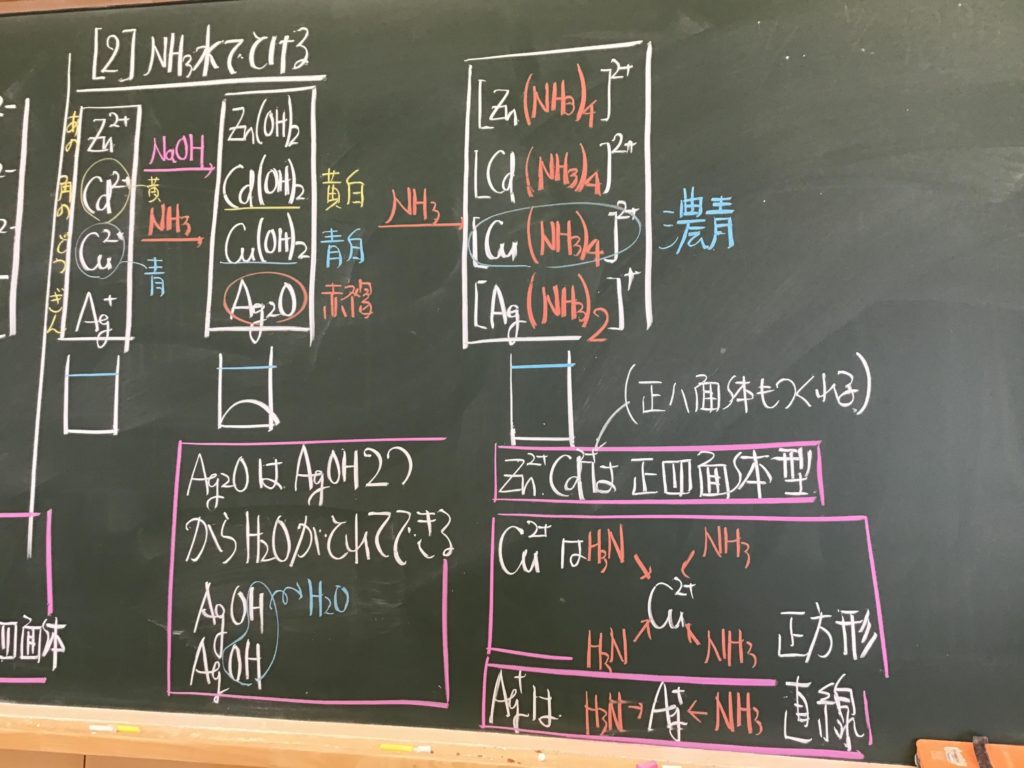
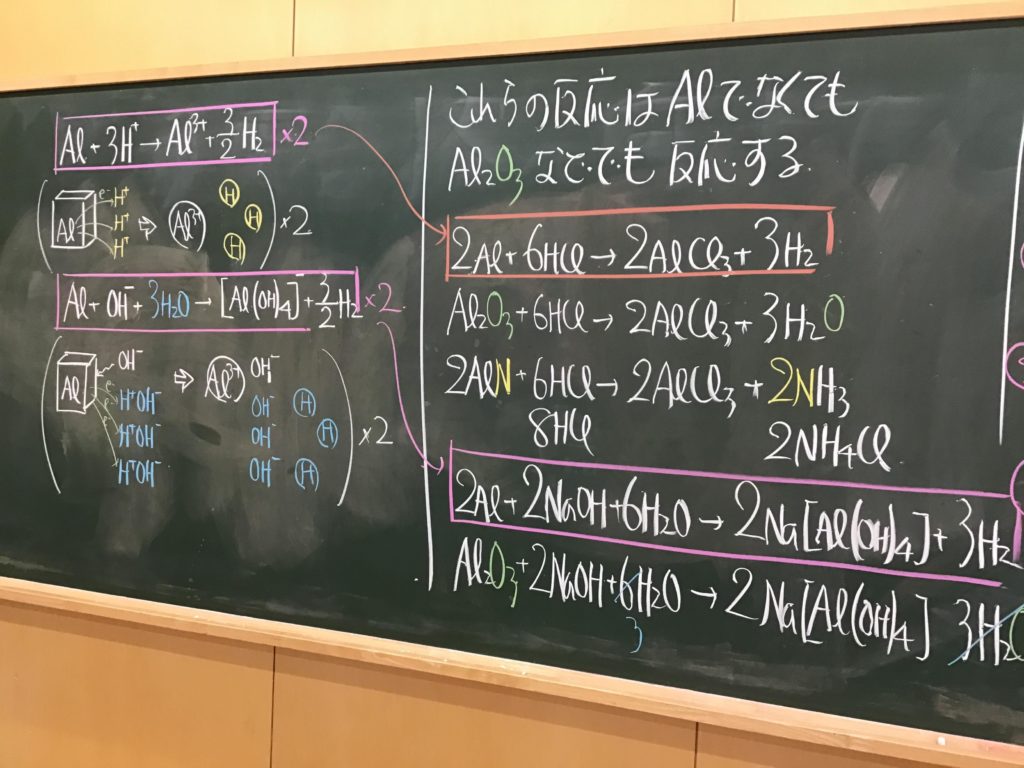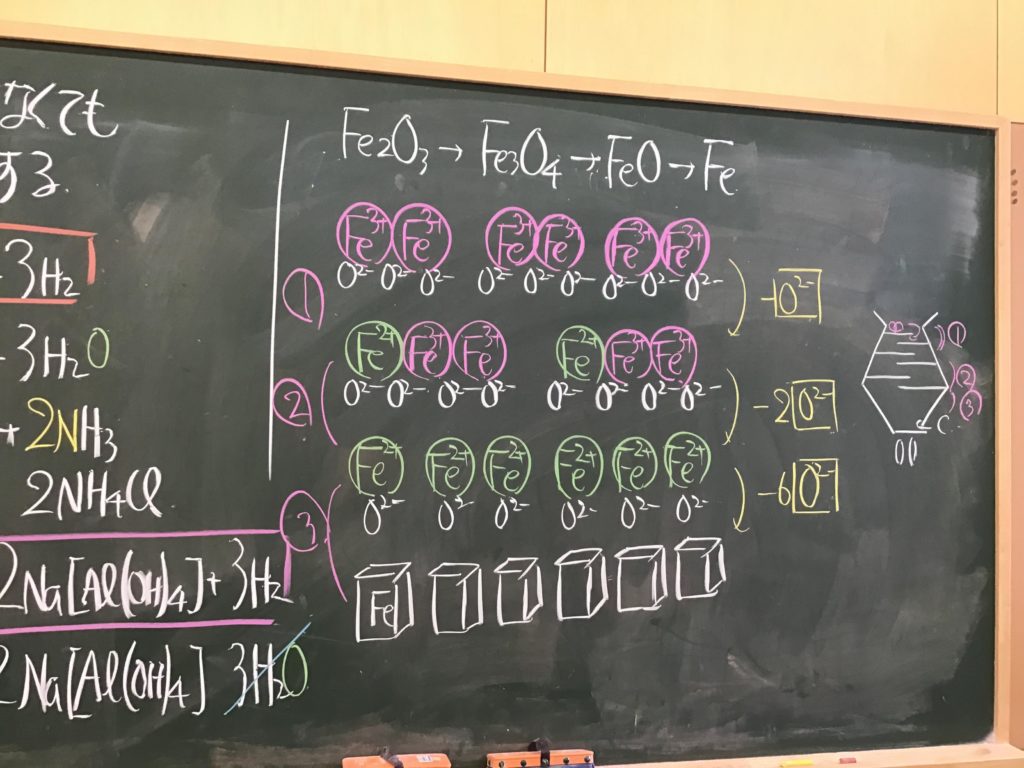第5回目の授業板書です。
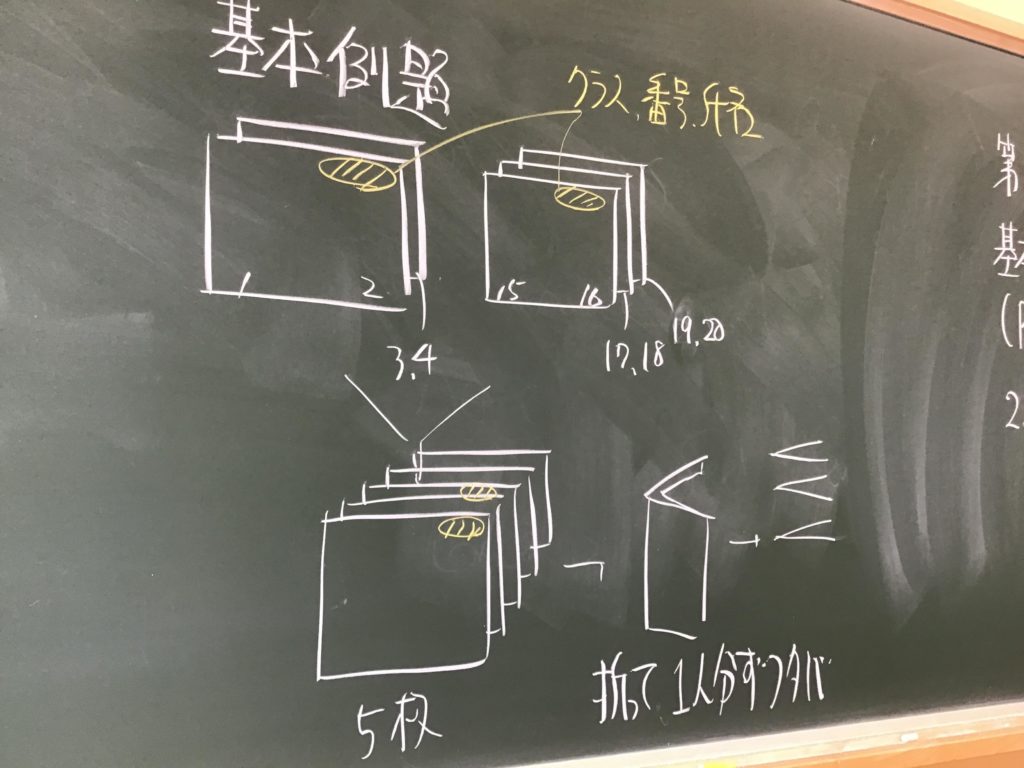






第5回目の授業板書です。







第5回目の授業板書です。







第5回目の授業板書です。





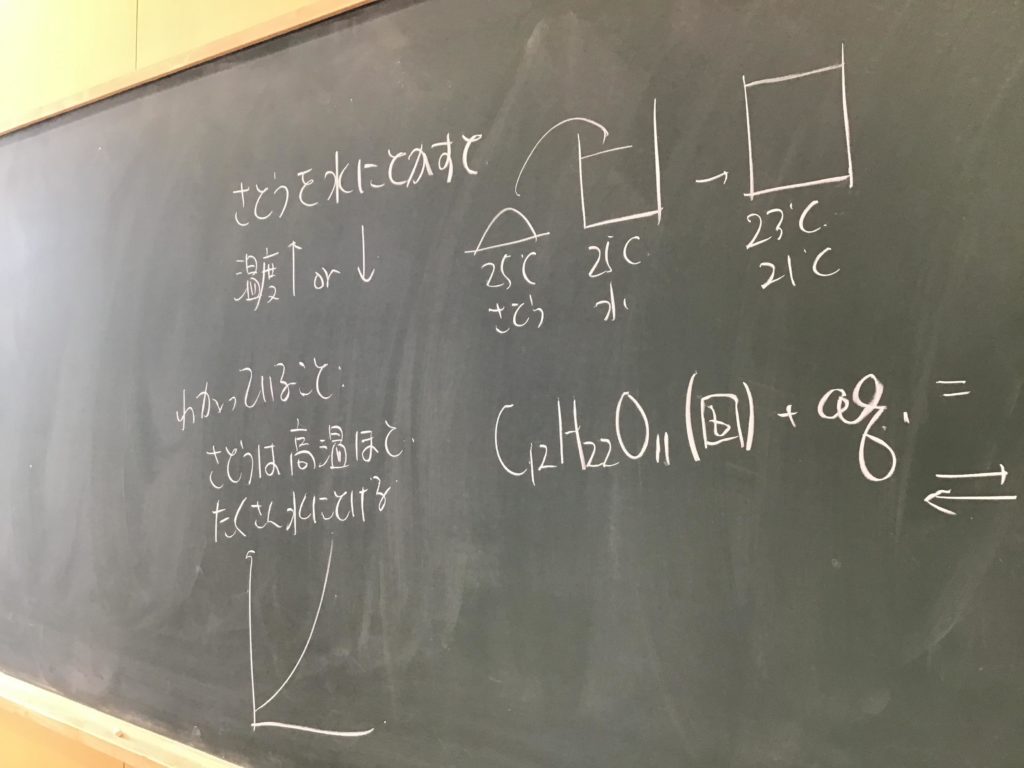
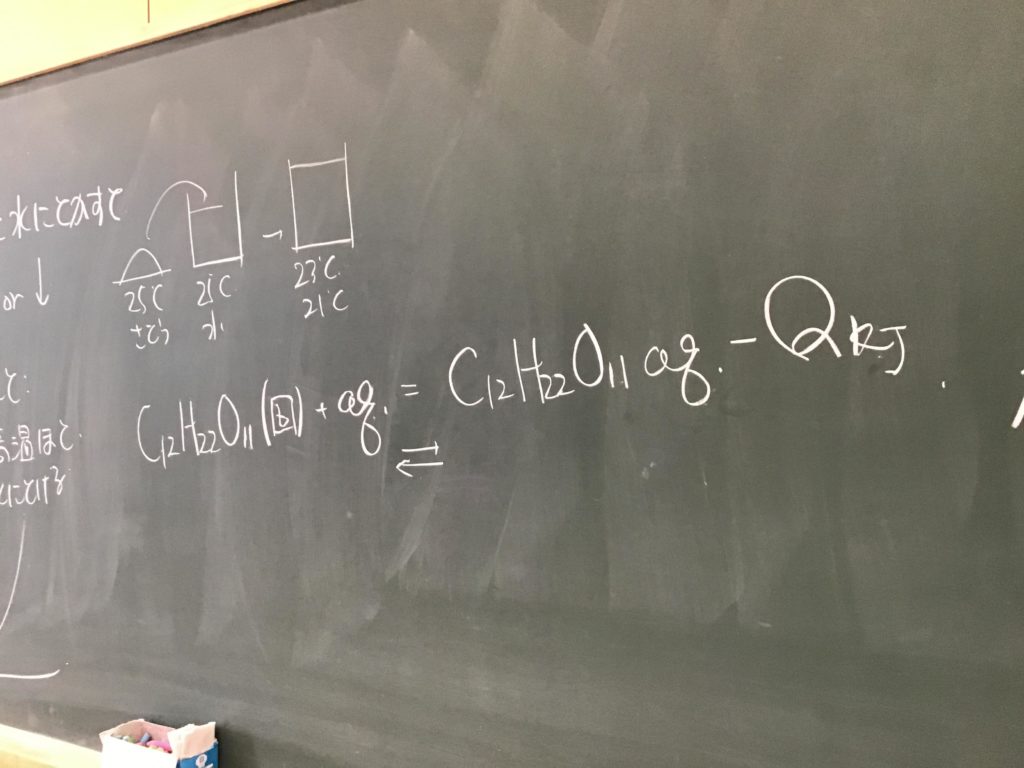

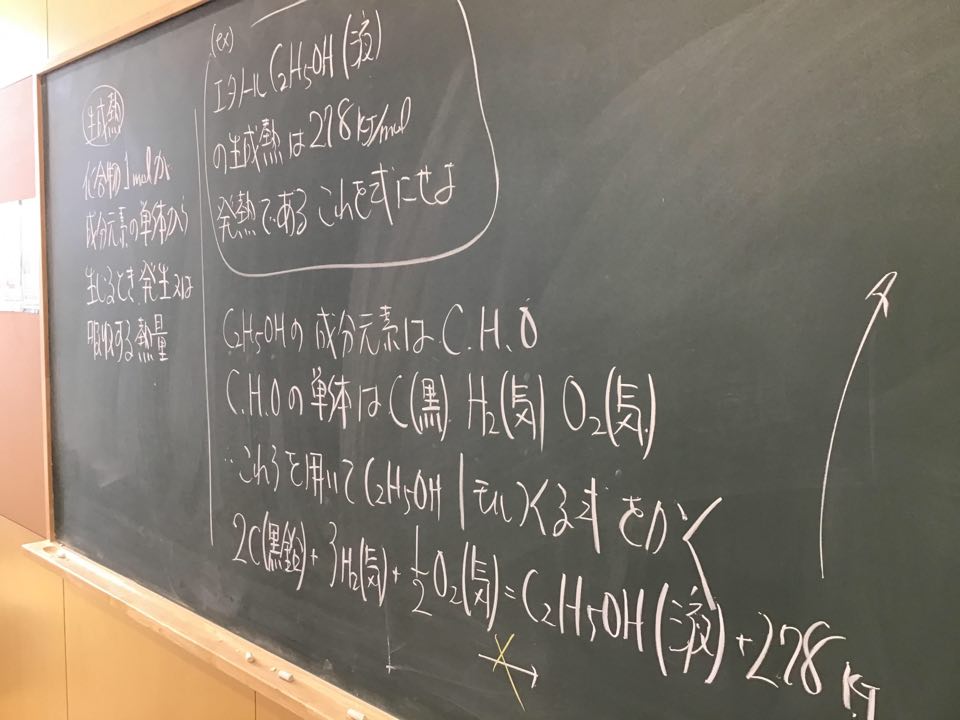
第4回目の授業板書です。




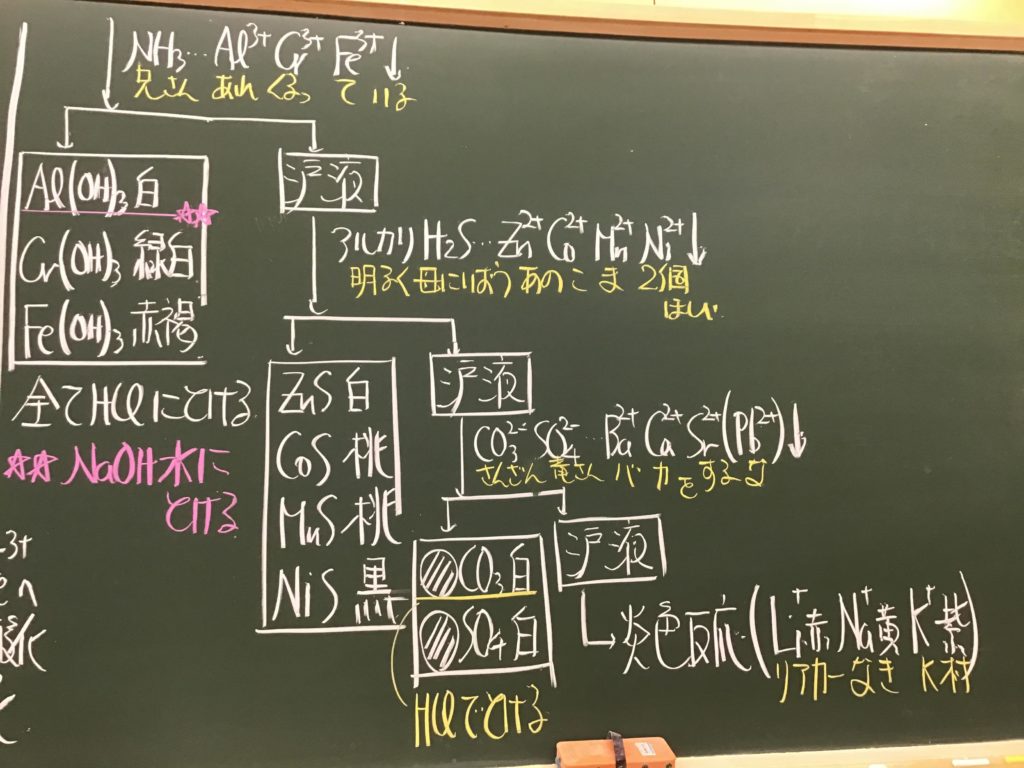

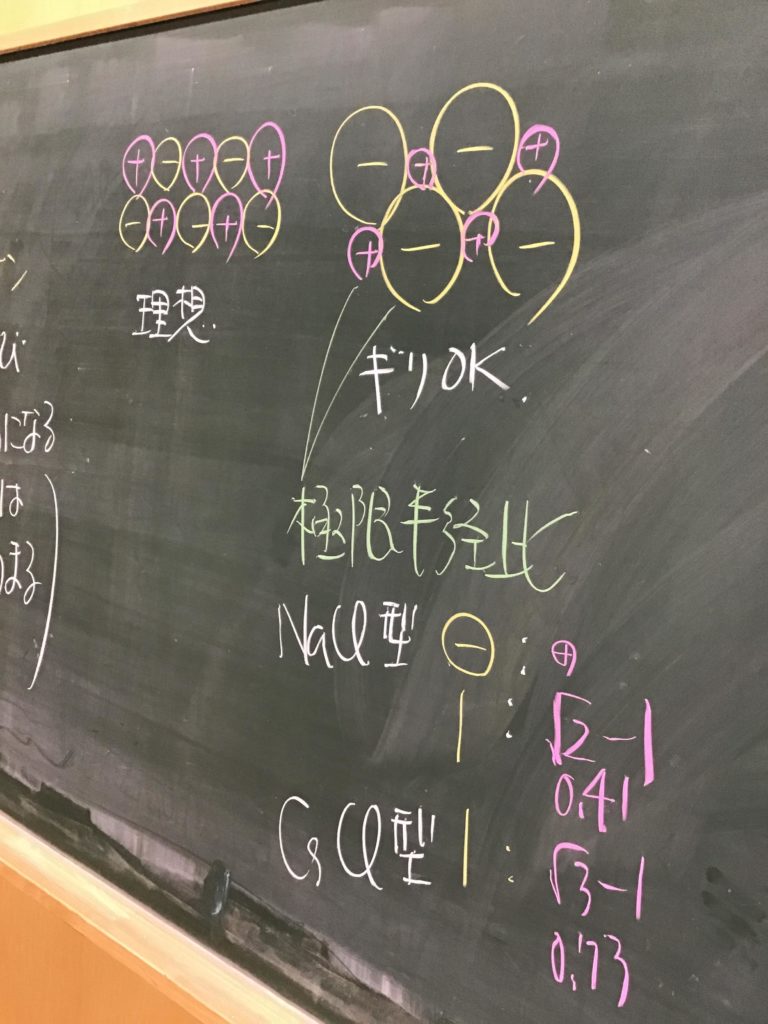
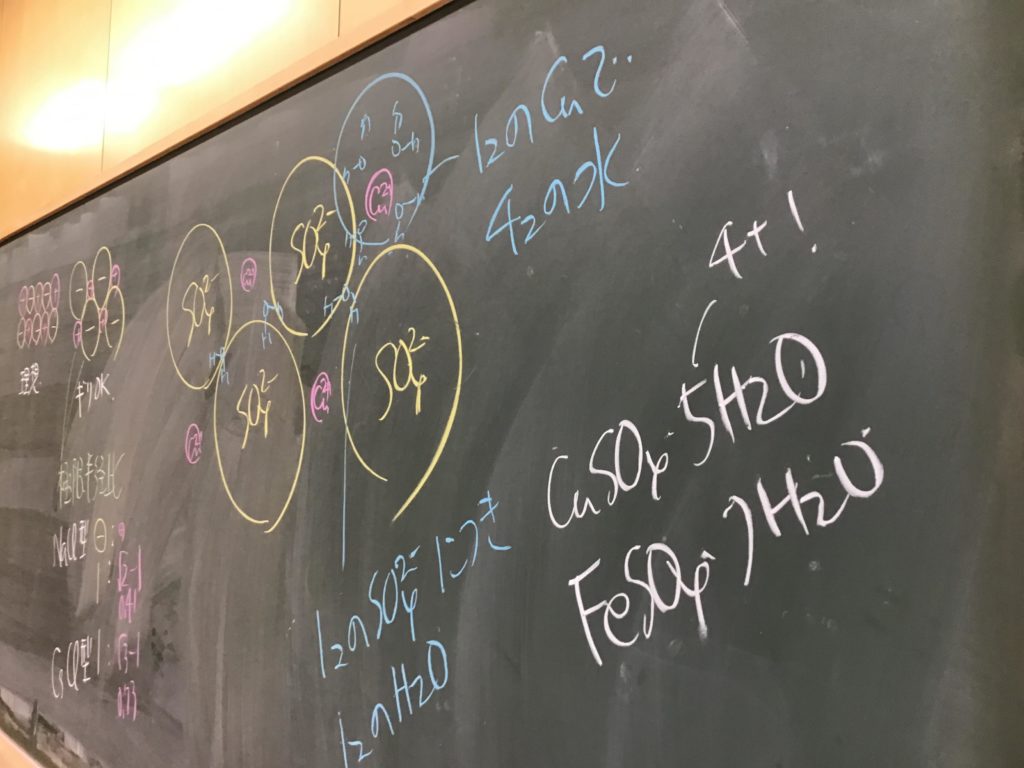
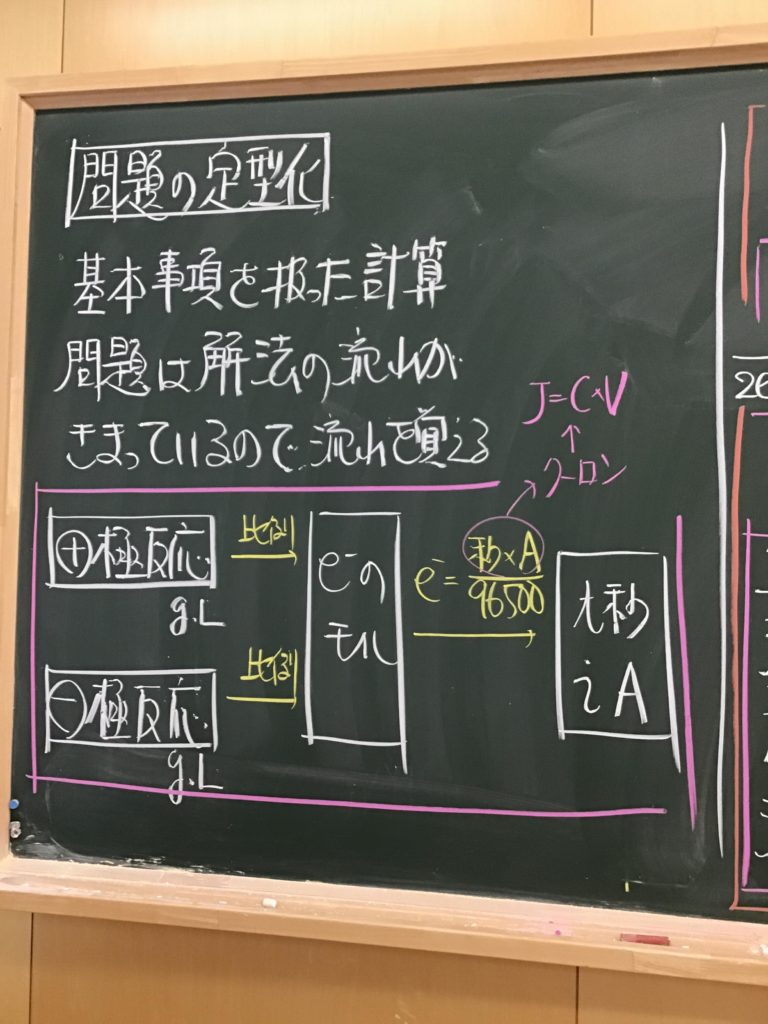

第4回目の授業板書です。


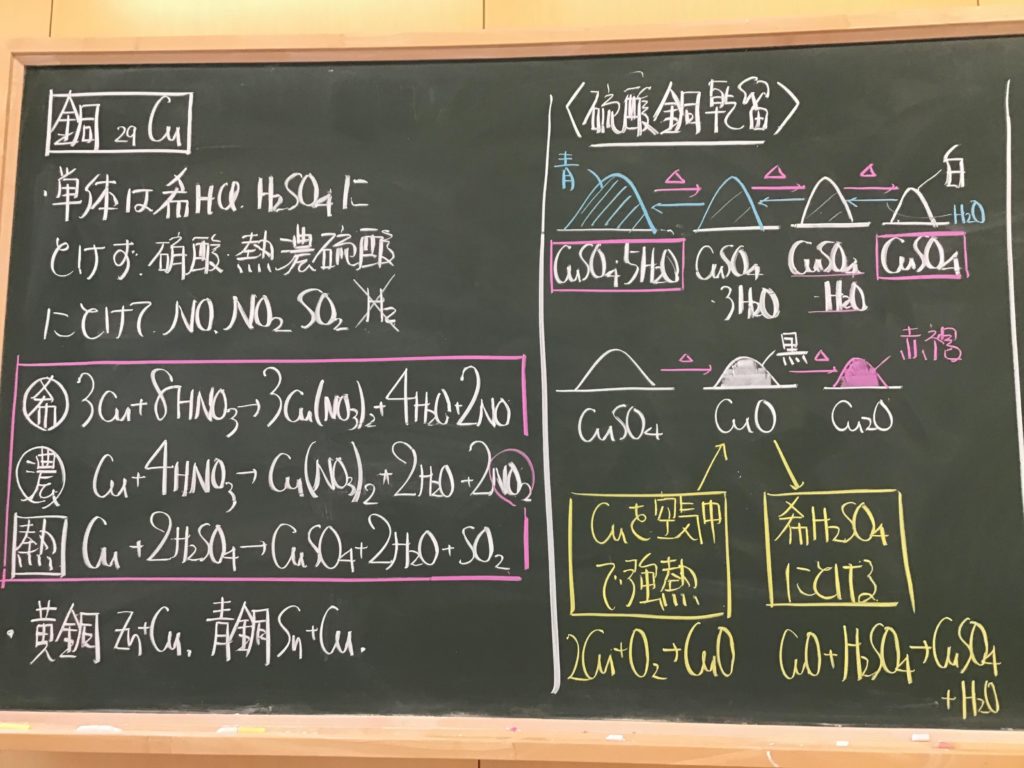

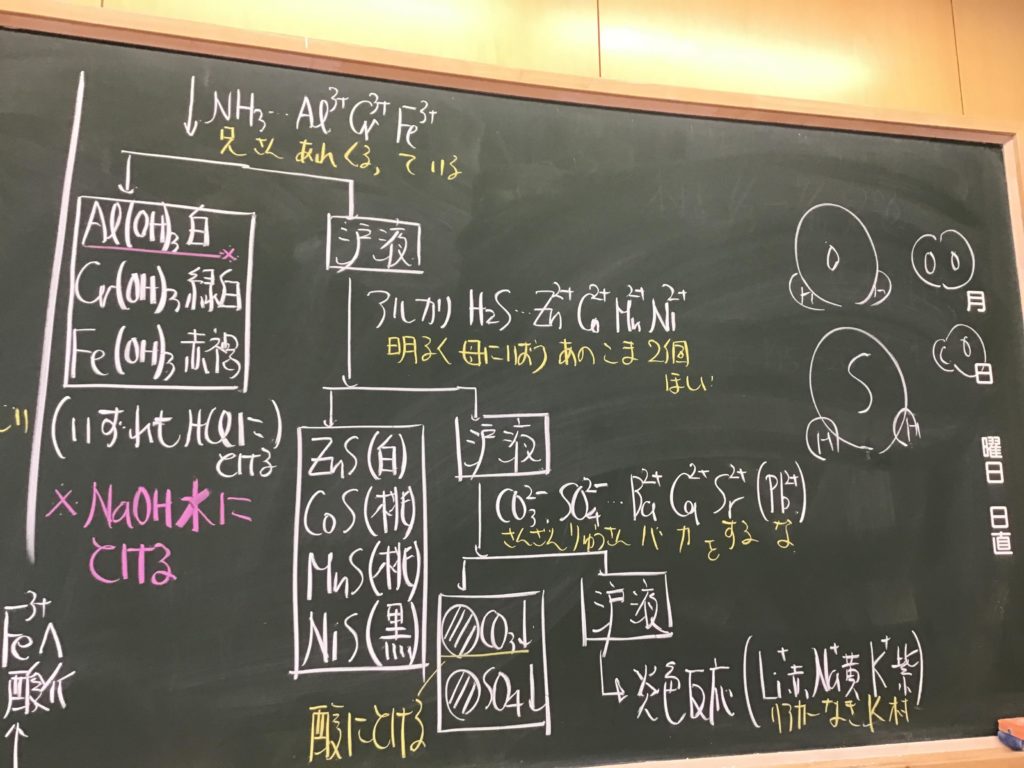

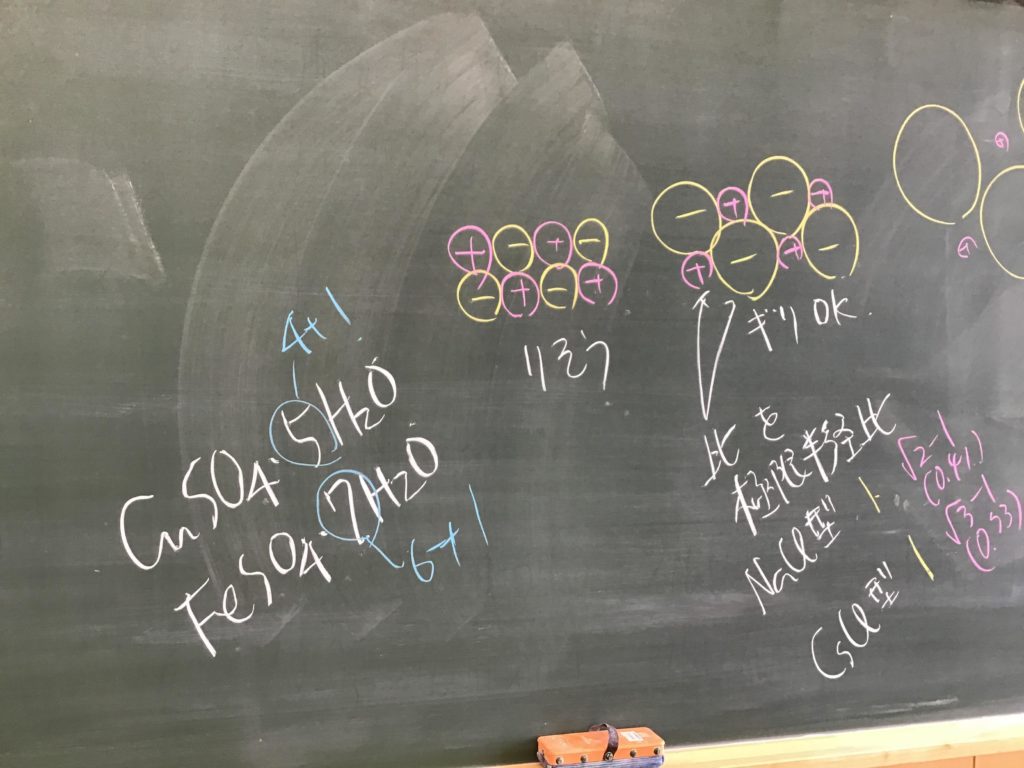
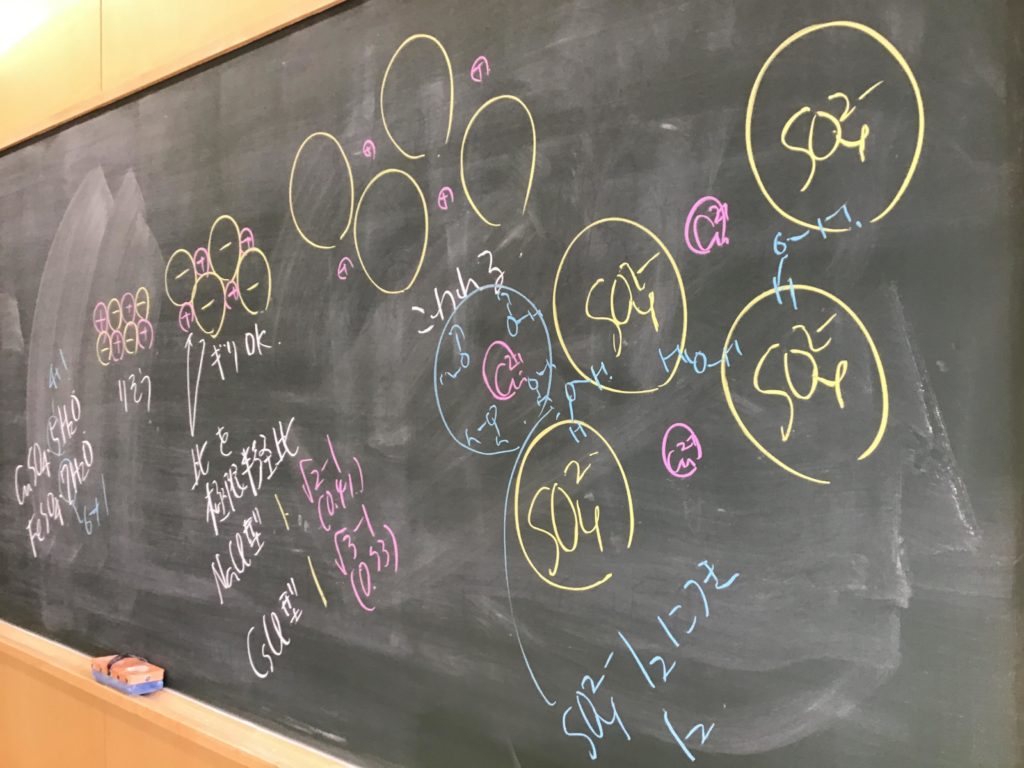

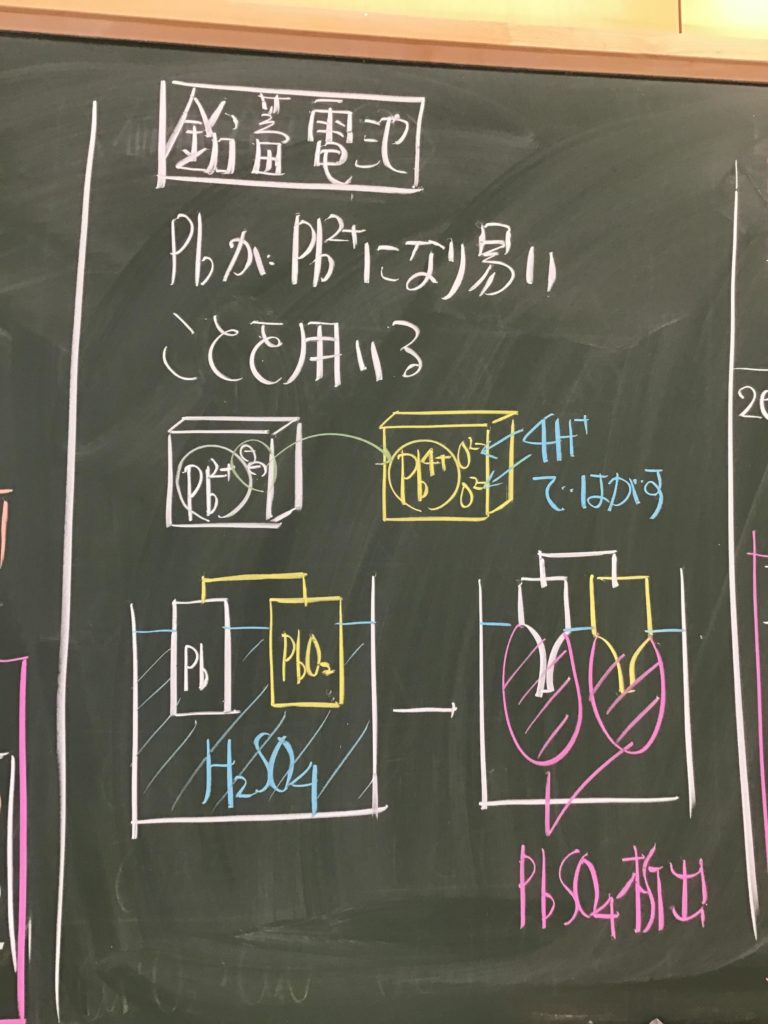
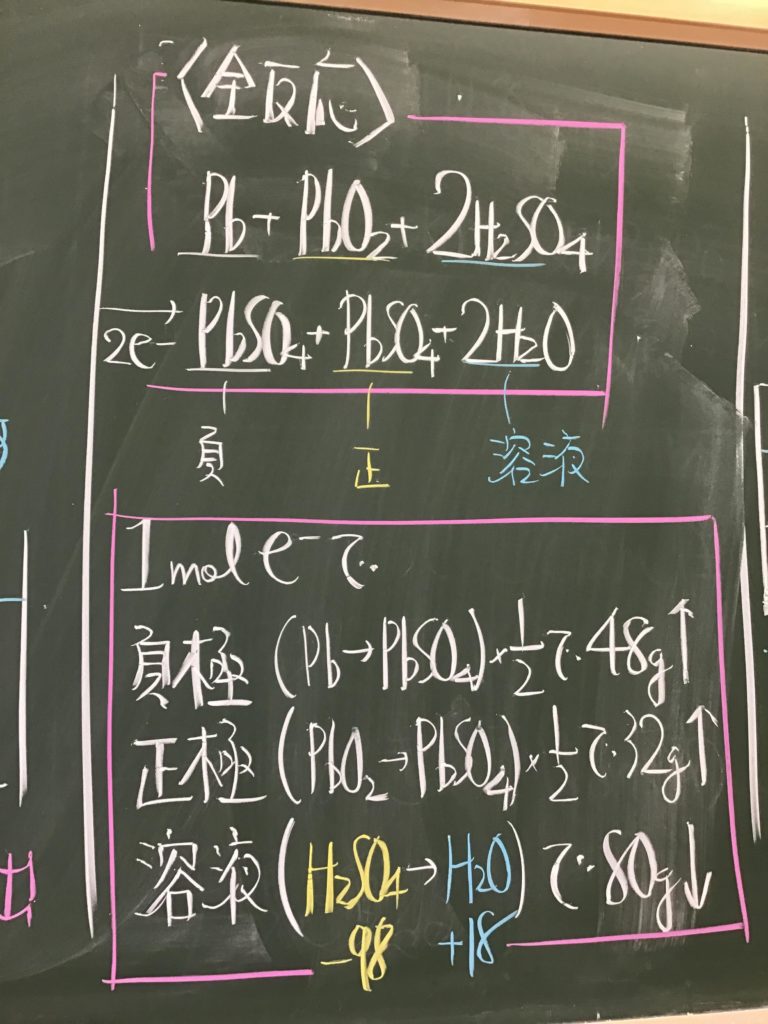
第4回目の授業板書です。




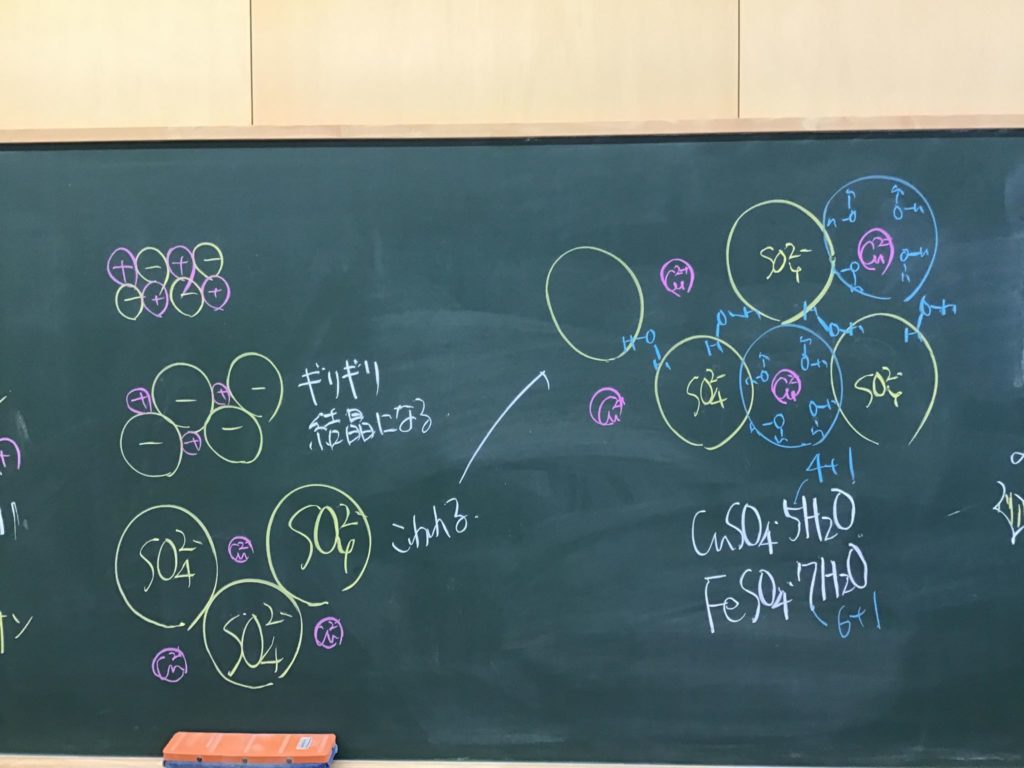

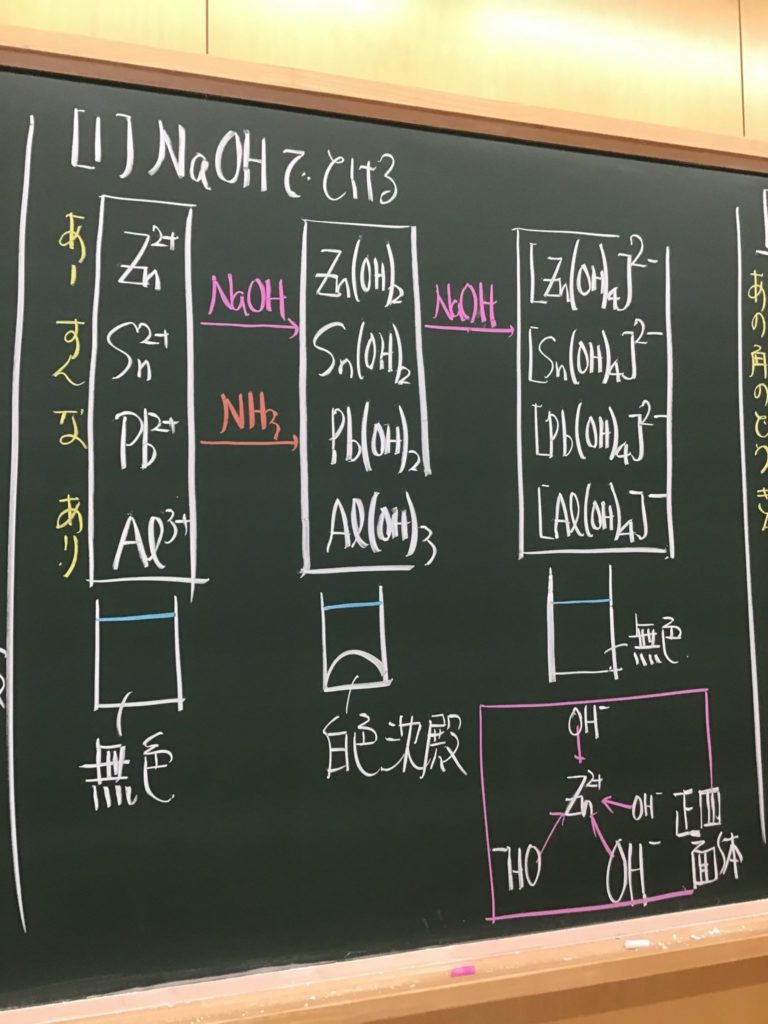

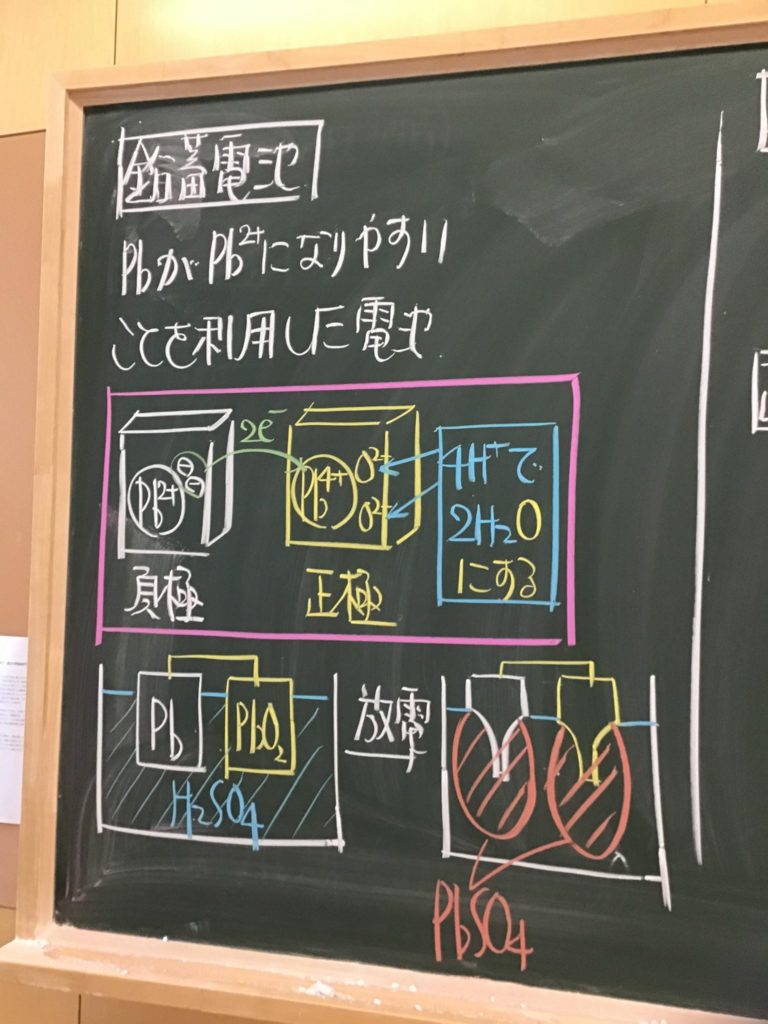


第4回目の授業板書です。




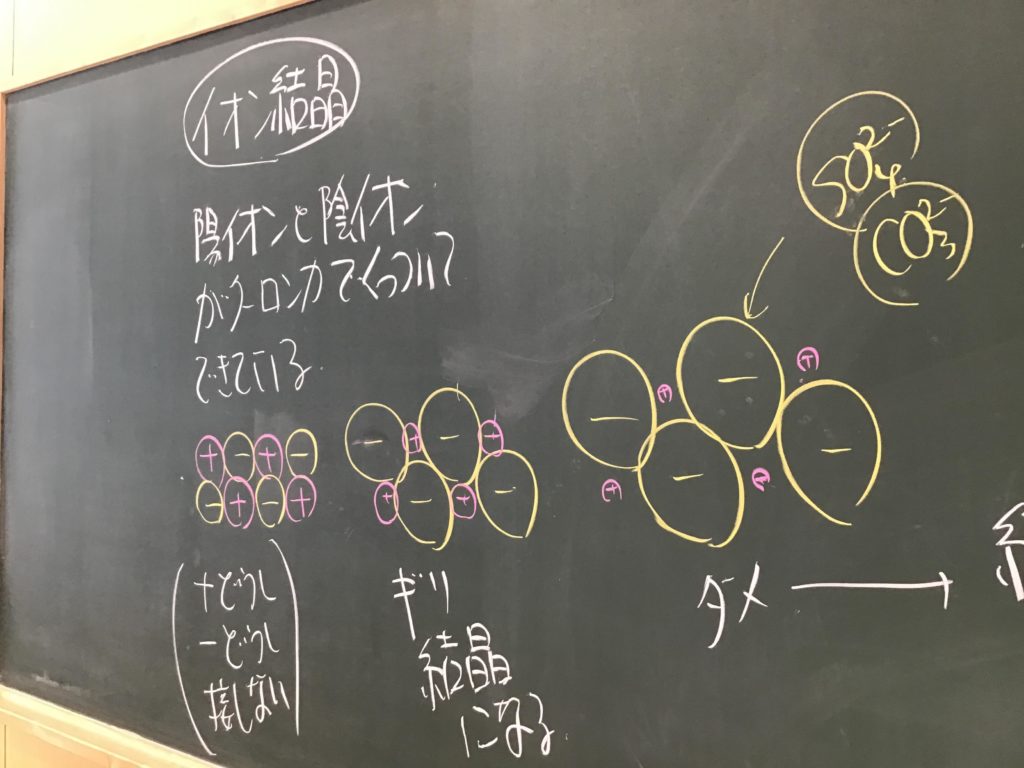
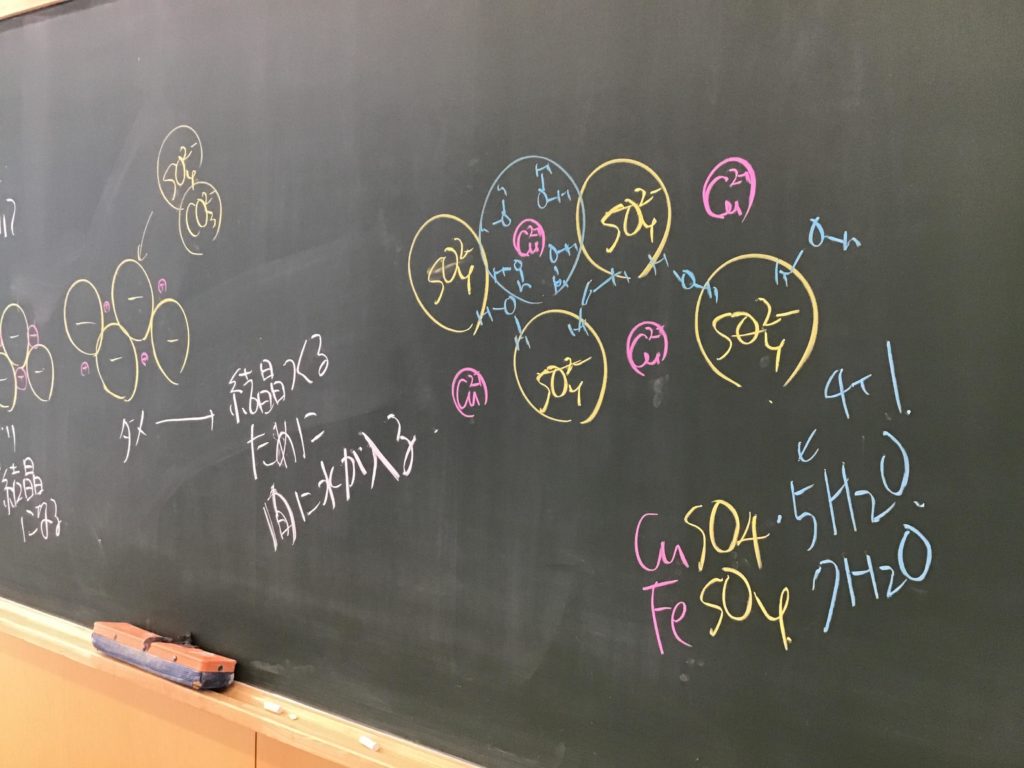


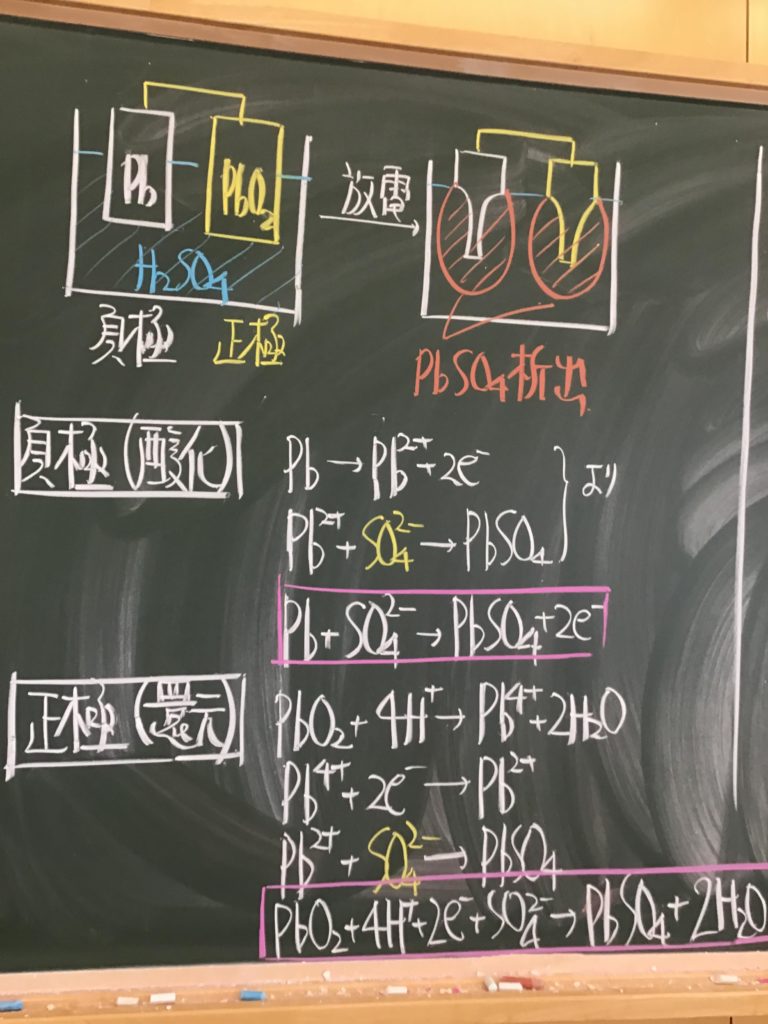

以下の課題については既に1ヶ月前から提出をお願いし,既に多くの皆さんに提出していただいておりますが,期限1ヶ月を過ぎて未だ未提の方がいます。
課題をノートやバインダーとして預かっている事例もあり、返却をしないと彼らの今後の学習に差し障りがありますので、7月1日より返却を開始します。
これに伴って、これ以降の追加評価は不可能になります。理由は授業でお話ししたように他者の課題の流用・剽窃の事例が過去にあったからです.
未提出の方で提出したい方は明日令和2年(2020年)7月1日(水)午前8時10分の始業の鐘が鳴る前に,北校舎5階化学教員室の松浦まで必ず提出してください.松浦がいない場合でも必ず「松浦先生の机の上に出すように言われました」と言って必ず提出してください.
これ以降に,成績を告知する書類を作成しますので,1限目と2限目の間の休み時間の提出も認めません。電車の遅延のようなもので,一人二人の無自覚な行動でみんなに迷惑がかかります.
締め切りの段階で成績は確定し,0点の方には0点と書いて成績表を提出します.如何なる相談にも応じません.残り3回の試験で巻き返してください.
第5回授業プリントの以下の3点を訂正します.プリントを直しておいてください!
訂正点1:基本例題081問題文(p.3)です.イオン化傾向はもともと日本独自のもので,半電池の実験を繰り返すことでイオン化のしやすさの順番を身近な金属で調べた「実験結果の順番」でした.これが標準酸化還元反応電位[mV]で表されて数値化されたことで広く世界中に受け入れられるようになりました.余談ですが僕が高校生の時には馬鹿馬鹿しいのですが「俺はイオン化傾向は認めない」と言って使わない・教えない運動をしている教師もおり,他のクラスの友達に「貸そうかなまあ…」と言ったら「ナニそれ?」と言われたこともあります.このイオン化列は歴史的に15種類の金属で構成されていましたが拡大バージョンが色々あって,ロシアのイオン化列は21種類の列,アメリカなどは16種類です.近年の日本は何でもアメリカラブなのでLiを加えた16種類になりました.ということで僕も大勢に迎合して16種類にしておきます.太字を直してLiを追加してください.
| 基本例題 081以下のイオン化列に存在する身近な16種類の金属に関する以下の問に答えなさい。(大)Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au(小) |
訂正点2:基本例題026解答(p.20)半反応式が抜けていました.
| 基本例題 026 解答(イオン化傾向の差が大きいほど起電力が大きいため。)AとB正極:Ag++e−→Ag 負極:Zn→Zn2++2e− |
訂正点3:演習問題B-7解答(p.26、5行目)問1の(2)の式の係数抜けです.
| 演習問題B – 7 解答 燃料電池は,水素と酸素の反応から電子の流れを取り出す装置である.水素は,H2 →2H+ + 2e− によって電子を放出することから,負極で用いる.一方,酸素は O2 + 4H+ + 4e−→ 2H2O によって電子を吸収することから正極で用いる.問1 (1) H2 → 2H+ + 2e− (2) O2 + 4H+ + 4e− → 2H2O (3) 水素が消費されるのは,(イ)負極 |
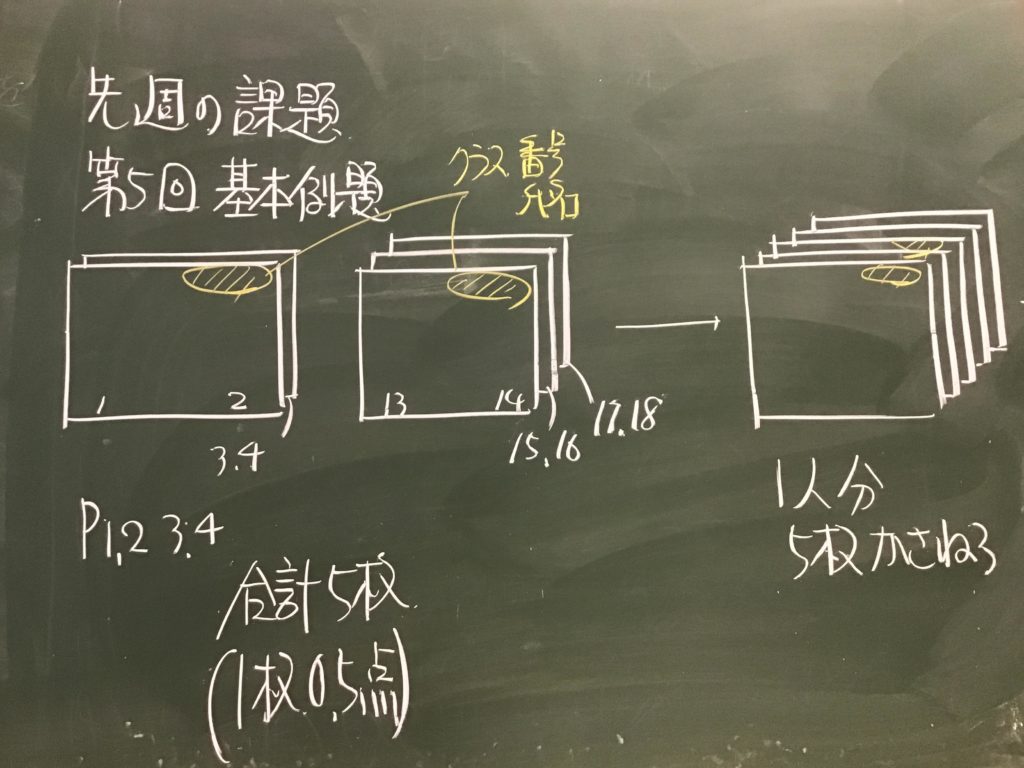
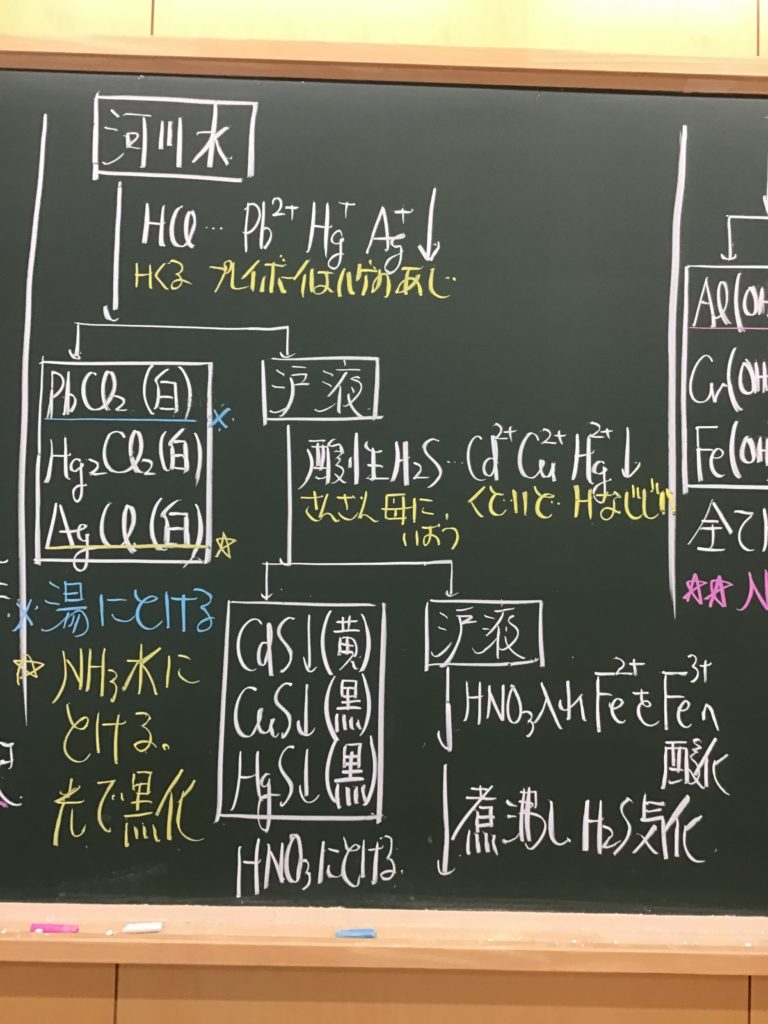
第3回目の授業板書です。
前回の「酸化還元半反応式プリント」は、北校舎5階 化学講義室前の机の上に置いてあります。出席番号偶数番号の人は、各自持って行ってください!
7/1(水)7時過ぎに僕が学校に着くまでが期限です.提出遅れの人はそこまでに出してくださいね!