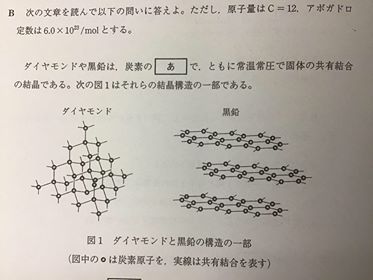
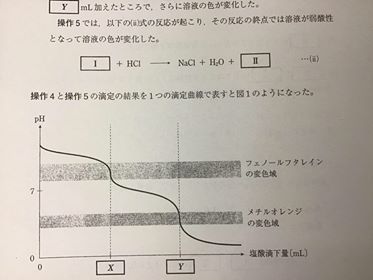
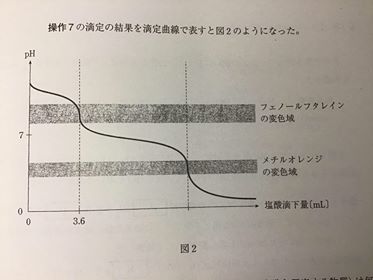
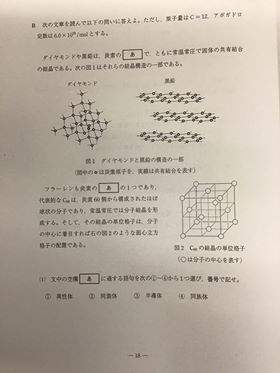
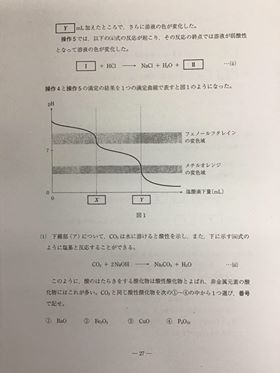
[ 2 ][ 3 ] [ 4 ] 各論
問1
(1) MnO4− + 8H+ + 5e− → Mn2+ + 4H2O
(2) Cr2O72− + 14H+ + 6e− → 2Cr3+ + 7H2O
(3) O2 + 4H+ + 4e− → 2H2O
(4) O2 + 2H2O + 4e− → 4OH−
(5) O3 + 2H+ + 2e− → H2O + O2
(6) NO3− + 4H+ + 3e− → NO + 2H2O
(7) NO3− + 2H+ + e− → NO2 + H2O
(8) SO42− + 4H+ + 2e− → SO2 + 2H2O
(9) F2 + 2e− → 2F−
(10) Cl2 + 2e− → 2Cl−
(11) Br2 + 2e− → 2Br−
(12) I2 + 2e− → 2I−
(13) 2H+ + 2e− → H2
問2
(1) H2S → 2H+ + 2 e− + S
(2) H2S + 2OH− → 2H2O + 2 e− + S
(3) H2C2O4 → 2CO2 +2H+ + 2e−
(4) 2S2O32− → S4O62− + 2 e−
(5) H2 → 2H+ + 2 e−
(6) H2 + 2OH− → 2H2O + 2 e−
(7) Na → Na+ + e−
(8) Ca → Ca2+ + 2 e−
(9) Mg → Mg2+ + 2 e−
(10) Al →Al3+ + 3e−
(11) Zn → Zn2+ + 2 e−
(12) Fe → Fe2+ + 2 e−
(13) Pb → Pb2+ + 2 e−
(14) Cu → Cu2+ + 2 e−
(15) Ag → Ag+ + e−
(16) 2Br− → Br2 + 2 e−
(17) 2I− → I2 + 2 e−
(18) Fe2+ → Fe3+ + e−
(19) Sn2+ → Sn4+ + 2 e−
問3
(1) H2O2 + 2H+ + 2e− → 2H2O
(2) H2O2 → O2 + 2H+ + 2e−
問4
(1) SO2 + 4H+ + 4e− → S + 2H2O
(2) SO2 + 2H2O → SO42− + 4H+ + 2e−
問5
(1) CH4 + 2H2O → CO2 + 8H+ + 8e−
(2) CH4 + 8OH− → CO2 + 6H2O + 8e−
(3) CH3OH + H2O → CO2 + 6H+ + 6e−
(4) CH3OH + 6OH− → CO2 + 5H2O + 6e−
(5) CH3CHO + H2O → CH3COOH + 2H+ + 2e−
(6) CH3CHO + 3OH− → CH3COO− + 2H2O + 2e−
問5のような半反応式は,特に燃料電池で負極に水素H2ではなく,有機物を用いた問題の時によく出てくる。実際,有機物は水とは混ざらないが,水系溶媒環境下において,酸化数が変化しない酸素を得るには,水から得ると便宜的に考える。O2との反応にしてしまうと,それは完全な酸化還元反応そのものであるため,半反応式としては認められない。